II. SUBSTANȚE. AMESTECURI DE SUBSTANȚE.
2.1. Substanțe pure și amestecuri de substanțe.
Definiţie
Substanța pură are o compoziție bine determinată, are constante fizice specifice și își păstrează compoziția în urma unor fenomene fizice.
Experiment
1. Substanță pură și impurități
Materiale necesare: 2 pahare Berzelius, apă, baghetă de sticlă, sare extrafină și sare grunjoasă.
Descrierea experimentului:
- Pune într-un pahar sarea extrafină și în celălalt, sarea grunjoasă.
- Adaugă apă în ambele pahare și dizolvă sarea prin agitarea cu bagheta și apoi observă conținuturile celor 2 pahare.
- Ce observi ?
Observaţie
În paharul cu apă și sare fină nu se deosebesc componenții, iar în celălalt, se depun pe fund substanțe închise la culoare.
Concluzia experimentului:
Sarea fină este o substanță pură, iar sarea grunjoasă este impură, adică conține impurități (alte substanțe pe lângă sare).
Pentru a exprima cât de curată este o substanță se folosește noțiunea de puritate.
Definiţie
Puritatea (p) reprezintă masa de substanță pură care se găsește în 100g de substanță impură. Ea se exprimă în procente (%).
Problemă model
1. Din 800g sare grunjoasă se obține 700g sare pură. Calculați puritatea zăcământului și procentul impurităților.
800g sare impură..................700g sare pură
100 g sare impură..................x g sare pură
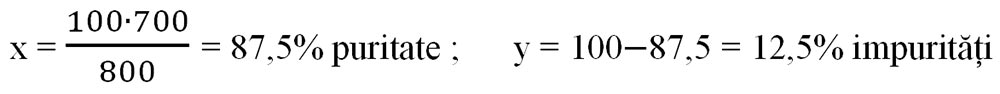
Definiţie
Amestecul este rezultatul punerii în comun a două sau mai multe substanțe între care nu au loc fenomene chimice (reacții chimice).
Zilnic folosești amestecuri sub diferite forme : preparate culinare, medicamente, pastă de dinți , detergenți, produse cosmetice, etc.
Experiment
2. Ce este un amestec de substanțe ?
Materiale necesare: mojar cu pistil, sulf, pilitură de fier, o picătură de mercur, magnet.
warning
Atenție! Mercurul este extrem de toxic ! Nu inhala vaporii săi! Nu îl atinge și nu il gusta!
Descrierea experimentului:
- Pune într-un mojar pulbere de sulf și pilitură de fier și amestecă cu pistilul.
- Apropie de acest amestec un magnet.
- Ce observi ?
Observaţie
Fierul din amestec nu își pierde proprietatea de a fi atras de magnet.
Sulful din amestec își păstrează și el proprietățile (pulbere galbenă).
Pune într-un mojar pulbere de sulf și o picătură de mercur și amestecă cu pistilul.
Ce observi ?
Observaţie
În scurt timp vei observa o pulbere neagră și formarea unei noi substanțe care nu mai are proprietățile celor 2 componente.
Concluzia experimentului:
Sulful cu fierul, amestecate în mojar, formează un amestec.
Sulful cu mercurul suferă un fenomen chimic, în urma căruia cele două substanțe nu își mai păstrează proprietățile.
important
A) Un amestec este format din doi sau mai mulți componenți.
B) Substanțele componente pot fi luate în diferite proporții.
C) Fiecare substanță componentă își păstrează proprietățile fizice și chimice.
important
Un amestec poate fi format din:
- Substanțe solide: solul, rocile, aliajele
- Substanțe lichide: diverse băuturi, antigelul
- Substanțe gazoase: aerul, gazele naturale
- Substanțe în cele 3 stări de agregare: apa tulbure ( apă + particule solide + aer dizolvat)
important
Obținerea amestecurilor :
a) Amestecarea componenților în stare gazoasă are loc de la sine prin fenomenul de difuzie, datorat mișcării dezordonate și continue a particulelor componente.
b) Amestecarea unui lichid cu:
- un gaz prin barbotarea (suflarea) gazului în lichid;
- alt lichid, tot de la sine prin difuzie;
- un solid, prin amestecare și dizolvare.
c) Amestecarea componenților în stare solidă cu ajutorul mojarului cu pistil.
important
După compoziția lor, amestecurile se clasifică în:
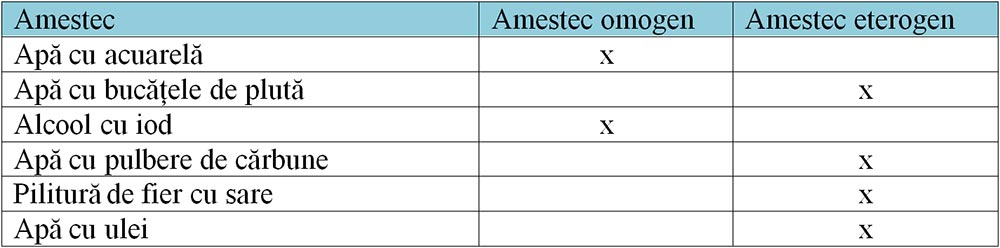
1) Amestecuri omogene care au aceeași compoziție și aceleași proprietăți în toată masa lor.
2) Amestecuri eterogene care nu au aceeași compoziție și aceleași proprietăți în toată masa lor și se observă cu ochiul liber sau cu lupa componenții săi.
Exemple de amestecuri omogene:
- soluții;
- aliaje;
- oțet;
- aer pur;
- spirt.

Exemple de amestecuri eterogene:
- sare grunjoasă;
- apă cu nisip;
- aer cu praf sau fum;
- solul;
- roci.

Problemă model
1. Dă câte 3 exemple de substanțe pure, amestecuri omogene și eterogene.

Problemă model
2. Identifică tipul amestecului din tabel.
2.2. Metode de separare a amestecurilor
2.2.1. Metode de separare a amestecurilor omogene
2.2.1.1. Cristalizarea
Definiţie
Cristalizarea este metoda de separare a unei substanțe solide sub formă de cristale dintr-un amestec omogen lichid (soluție), prin evaporarea substanței lichide.
Experiment
3. Cristalizarea
Materiale necesare: pahar Berzelius, apă, cristale de bicromat de potasiu, baghetă, sită de azbest, spirtieră, chibrit, capsulă, trepied.
Descrierea experimentului:
- În pahar amestecă apa cu bicromatul de potasiu cu ajutorul baghetei.
- Pune amestecul format într-o capsulă, pe care o așezi pe sita de azbest de pe trepied și încălzește-l la flacăra spirtierei.
- Ce observi ?
Observaţie
Apa se evaporă și se obțin în capsulă cristale de bicromat de potasiu.
Concluzia experimentului:
Prin cristalizare am separat o substanță solidă sub formă de cristale dintr-un amestec omogen lichid (soluție), prin evaporarea apei.
Aplicaţiile cristalizării
Extragerea sării din apa de mare.
Extragerea zahărului din trestia/sflecla de zahăr.
2.2.1.2. Distilarea
Definiţie
Distilarea constă în separarea componentelor lichide dintr-un amestec omogen, pe baza punctelor lor de fierbere diferite.
important
În timpul distilării au loc două fenomene fizice: vaporizarea, urmată de condensare.

Dacă în balon există un amestec de apă cu alcool, prin încălzire, temperatura va crește, iar când ajunge la 78°C, alcoolul începe să fiarbă.
Pe toată durata fierberii alcoolului, temperatura rămâne constantă, la 78°C. Vaporii de alcool ajunși în refrigerent, sunt răciți și condensează.
Când temperatura începe să crească depășind 78°C, alcoolul s-a separat de apă și se oprește distilarea. Apa s-a separat de alcool.
Observație
În general, părțile componente ale amestecului au puncte de fierbere care nu diferă cu mai mult de 25 °C între ele, în condiții de presiune de o atmosferă. În schimb, dacă diferența dintre punctele de fierbere este mai mare de 25 °C, se poate folosi pentru separarea componenților o distilare simplă.
Aplicaţiile distilării
1) Obținerea apei distilate (pură din punct de vedere chimic), folosită în laboratoare, industrie, farmacie.

2) Obținerea băuturilor alcoolice în instalații industriale cu alambic.

3) Prin distilarea fracționată a petrolului, în rafinăriile petrochimice se obțin propan, butan, benzine, petrol lampant, motorină, păcură. Aceste produse ale distilării petrolului se folosesc drept combustibili, la obținerea maselor plastice, medicamentelor, cauciucului artificial, fibrelor artificiale, detergenți, insecticite, pesticide, etc.

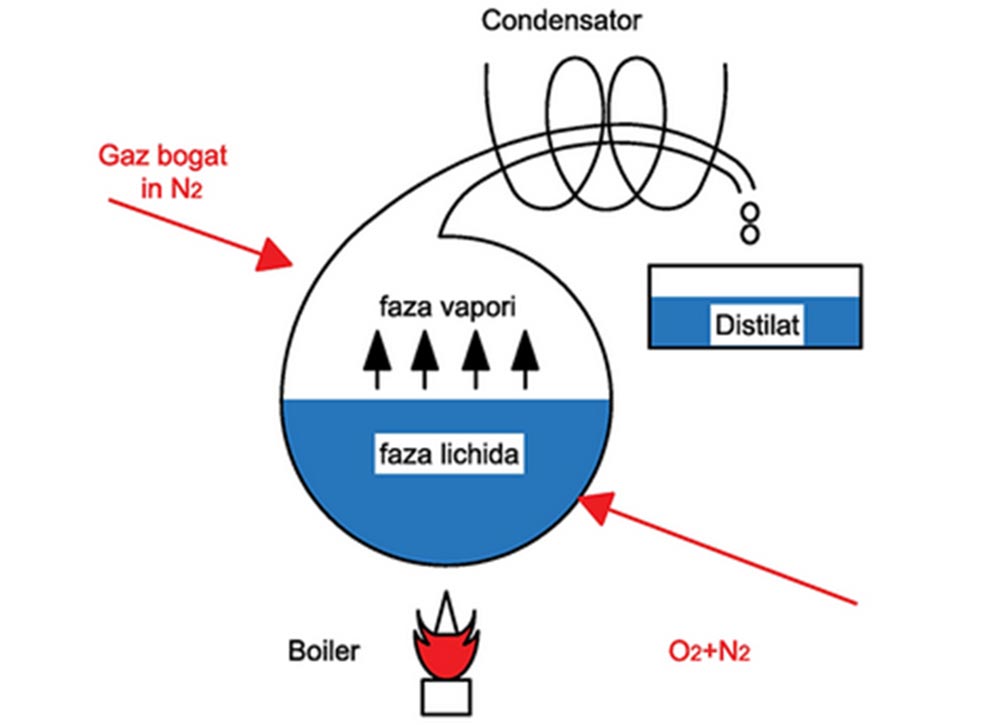
4) Distilarea fracționată a aerului, cu separarea azotului de oxigen. Se consideră un balon de distilare care conține un amestec lichid de oxigen (componentul greu) și azot (componentul ușor). Dacă amestecul lichid este încălzit, acesta va începe să fiarbă, producând vapori care conțin mai mult azot (componentul ușor) decât lichidul inițial. Acești vapori bogați în azot condensează într-un condensator.
2.2.2. Metode de separare a componentelor unui amestec eterogen
2.2.2.1. Decantarea
Definiţie
Decantarea este metoda de separare a componentelor unui amestec eterogen solid – lichid sau lichid –lichid pe baza diferenței mari dintre densitățiile acestora.
important
a) Pentru componente solid-lichid având densități cu mult diferite, se folosește decantarea cu ajutorul baghetei (când solidul stă la fundul lichidului) .
b) Pentru componentele lichid-lichid cu densități diferite și care sunt nemiscibile (nu se dizolvă unul în altul), se folosește decantarea cu pâlnia de separare.
Experiment
4. Decantarea unui amestec de apă+ulei+nisip
Materiale necesare: 2 pahare Berzelius, baghetă, pâlnie de separare, apă,ulei,nisip, stativ.
Descrierea experimentului:
- Cu ajutorul baghetei, se toarnă partea lichidă a amestecului în pâlnia de separare. În pahar rămâne nisipul.
- Se desface robinetul pâlniei de separare astfel încât, apa care are densitatea mai mare, va curge în pahar, iar uleiul cu densitatea mai mică va rămâne în pâlnia de separare.
- Ce observi ?
Observaţie
Prin decantare am separat nisipul de apa cu ulei, cu bagheta, apoi am separat apa de ulei cu pâlnia cu robinet.
Concluzia experimentului:
Prin decantare am separat componentelor unui amestec eterogen solid – lichid sau lichid – lichid, pe baza diferenței dintre densitățiile acestora
Aplicaţiile decantării
1. Obținerea apei potabile în bazine decantoare de mari dimensiuni, în care impuritățile solide se depun pe fundul decantorului și apa se limpezește și se epurează(curăță) mecanic .

2. Separarea celor 2 componente ale varului stins: apa de var și laptele de var.

2.2.2.2. Filtrarea
Definiţie
Filtrarea este metoda de separare a unei substanțe solide dintr-un amestec eterogen solid-lichid care au densități apropiate, cu ajutorul unui material filtrant (hârtie de filtru).
Observaţie
Observație: Când densitatea solidului este mult mai mare ca cea a lichidului din amestec, aplicăm decantarea, iar când densitatea solidului este asemănătoare cu cea a lichidului (solidul nu se depune la fundul lichidului, ci este peste tot împrăștiat prin lichid), aplicăm filtrarea.
Experiment
5. Filtrarea unui amestec eterogen
Materiale necesare: 1pahar Berzelius, 1 pahar Erlenmeyer, baghetă, pâlnie , hârtie de filtru, apă, pulbere de sulf (pulbere de cărbune, praf de cretă, bobițe de plută, frunze de ceai, cafea măcinată, etc).
Descrierea experimentului:
- În paharul Berzelius se amestecă apa cu pulberea de sulf.
- Se împăturește în patru hârtia de filtru, se desparte o foaie de celelalte, se aplică pe pereții interiori ai pâlniei umezită.
- Amestecul se toarnă în pâlnie pe o baghetă de sticlă înclinată spre peretele lateral, spre partea triplă a filtrului.
- Ce observi ?
Observaţie
Pentru a separa apa de pulberea de sulf am folosit filtrarea.
Concluzia experimentului:
Prin filtrarea am separat o substanță solidă dintr-un amestec eterogen solid-lichid, cu densități apropiate, cu ajutorul unui hârtiei de filtru.
Aplicaţiile filtrării:
1. Filtru pentru apă potabilă (bună de băut)

2. Filtru pentru aer (automobile, aer condiționat, aspiratoare, industriale pentru reținerea gazelor poluante, etc)

3. Filtru de ulei la automobile.

4. Filtru de cafea.

Problemă model
1. Tudor are la dispoziție următoarele instrumente: spirtieră cu trepied și sită de azbest, magnet, pâlnie cu filtru, pahare, baghetă, pâlnie cu robinet.
Ce echipament este necesar pentru a extrage fiecare substanță enumerată în coloana 2? Scrie răspunsurile în tabel.

2.2.2.3 Aplică ce ai învățat în legătură cu Metodele de separare a amestecurilor
Temă
1) Lucian dorește să separe un amestec de sare, nisip și pilitură de fier în trei substanțe solide separate. El a parcurs următorii pași:
- A împrăștiat amestecul pe o coală de hârtie și a treacut un magnet pe deasupra lor.
- A pus restul amestecului într-un pahar și a adăugat apă.
- A filtrat amestecul de apă.
A reușit Lucian să separe amestecul inițial în trei substanțe solide când a finalizat acești trei pași? Explică răspunsul tău.
Temă
2) Daniela dorește să separe un amestec de apă cu ulei.
Ea folosește următoarea instalație:

a) Denumește ustensilele folosite în acest experiment.
b) Ce fel de amestec formează apa cu uleiul?
c) Ce lichid a curs în pahar după deschiderea robinetului ? Explică răspunsul.
2.3. Solul - amestec eterogen
Litosfera (din grecescul lithos = piatră și sferă) este partea solidă de la exteriorul unei planete. În cazul Terrei, litosfera include scoarța terestră și partea superioară a mantalei.
Definiţie
Solul este stratul situat la suprafața scoarței terestre (partea superioară a litosferei).
important
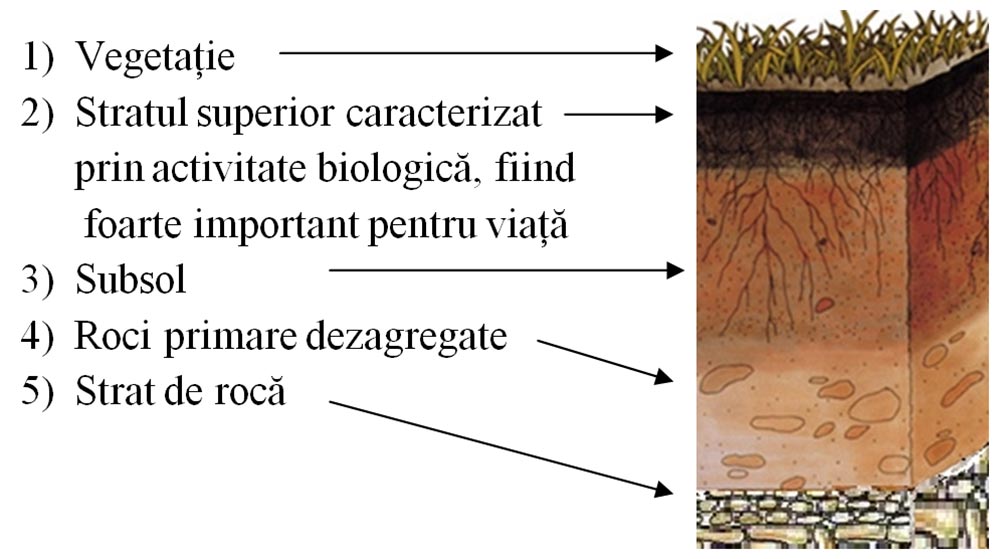
Structura solului:
Principalele tipuri de sol
- Solul nisipos conține particule mari de nisip, este aerat și drenat (apa pătrunde ușor prin el). Este folosit la fabricarea vaselor ceramice.

Observaţie
Solul nisipos, de exemplu, este uşor şi poros, permiţând trecerea apei şi fiind uşor de lucrat, însă nu reţine nutrienţi. Umeziţi pământul şi frecaţi o bucată între degete. Dacă pământul se scurge printre degete, este nisipos.
Este folosit la fabricarea sticlei.
Principalele tipuri de sol
- Solul argilos arată ca un nisip maroniu, uscat formează bulgări, fiind bogat în substanțe minerale nutritive (roditor). Este folosit la obținerea sticlei.

Observaţie
Solurile argiloase se compactează (se bătătoresc) ușor când sunt călcate în timp ce sunt umede și se usucă tare în timpul verii, formând crăpături serioase pe timp de secetă. Are o mare densitate, este greu permeabil, în schimb odată pătruns de apă, o reține multă vreme.
Ia un pumn de sol umed şi strânge-l cu putere în palmă. Dacă la deschiderea pumnului remarci o formațiune compactă de pământ, ce se lipește de palmă, atunci ai în grădină un sol argilos.
De altfel, solul argilos este simplu de identificat și în absența acestui test. Un astfel de sol se lipește de încălțări și de uneltele de grădină, se grupează în bulgări mari de pământ, greu de sfărâmat.
Este folosit la obținerea vaselor ceramice.
Principalele tipuri de sol
- Solul calcaros are aspect albicios, conține o mare cantitate de pietre fiind predispus la uscare, blochează pătrunderea magneziului și a fierului. Este folosit la obținerea varului

Observaţie
Solul calcaros are un aspect albicios si are o cantitate mare de pietre fiind predispus la uscare, blochează pătrunderea magneziului și a fierului.
Este un tip de sol lipicios și greu de lucrat cu el când este umed, iar vara se usucă foarte repede.
Deși absoarbe eficient umiditatea, solul calcaros favorizează și înghețul profund. În plus, nu reține în mod corespunzător substanțele nutritive, fapt care poate duce, spre exemplu, la cloroză (îngălbenirea) frunzelor.
Ia o lingură de sol și pune-o într-un vas, adăugând oțet. În cazul în care apar bule albe de dioxid de carbon, înseamnă că solul din grădina ta are un conținut crescut de carbonat de calciu.
Este folosit la obținerea varului.
important
Solul este un amestec eterogen de materie organică (rădăcini de plante, mici organisme, resturi de vietăți aflate în descompunere care formează humusul) și materie anorganică (roci, apă, oxigen, dioxid de carbon, azot).
Substanțele minerale se pot găsi în sol în:
- Cantitate mare - macroelemente - : siliciu, aluminiu, potasiu, calciu ,fier, magneziu.
- Cantitate mică - microelemente - : iod, fluor, brom, cobalt, mangan, cupru, molibden, crom etc.
Plantele nu se dezvoltă normal în solurile sărace în substanțe minerale.
Pentru a asigura solurilor substanțele nutritive necesare, se folosesc îngrășăminte naturale (mraniță-gunoi de grajd putrezit, compost-amestec de resturi de plante, cenușă, etc) sau îngrășăminte chimice (azotați, fosfați).
Importanța solului
Solul produce hrană și materii prime, 95 % din hrana pe care o consumăm provine direct sau indirect din sol.
Curăță apa potabilă .
Găzduiește organisme cu potențial farmaceutic.
Solul fertil previne eroziunea.
Reține apa și reduce riscurile de inundații .
Stochează cantități uriașe de carbon.
Anual, în Europa dispar 1 000 km² de sol (suprafață egală cu a unui oraș precum Berlinul) ca urmare a extinderii orașelor și a infrastructurii.
Protejarea acestei resurse fragile neregenerabile este vitală pentru asigurarea unui viitor sănătos. Formarea a 2 cm de sol fertil poate dura până la 500 de ani.
2.4. Aerul – amestec omogen
Definiţie
Atmosfera este învelișul de aer care înconjoară Pământul.
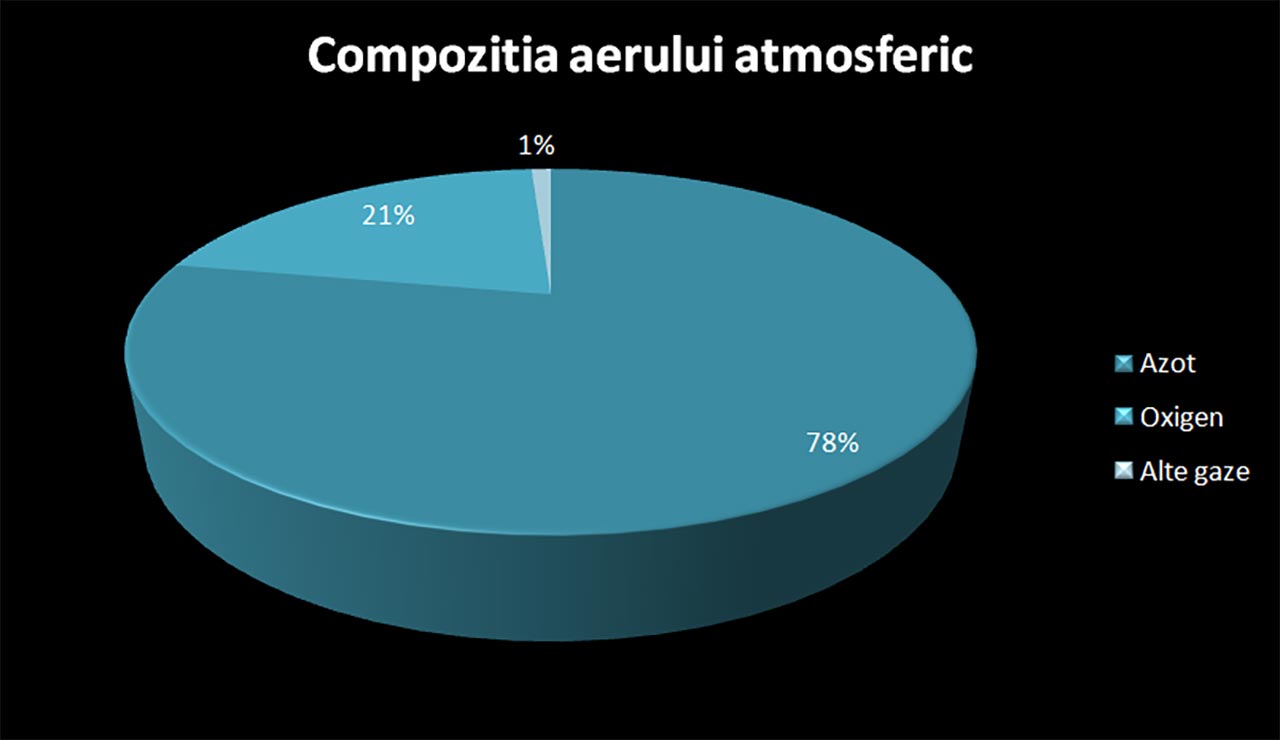
Atmosfera Pământului conține:
- azot (nitrogen) molecular diatomic (N2) în proporție de 78%;
- oxigen molecular diatomic (O2) în proporție de 21%;
- argon (Ar) în proporție de 0,92%;
- dioxid de carbon (CO2) în proporție de 0,04%;
- ozon sau oxigen triatomic (O3);
- alte gaze, praf, fum, etc.
Atmosfera terestră are o masă de cca 4,9 • 1018 kg și este alcătuită, în funcție de temperatură, din mai multe straturi:

Observaţie
De ce este cerul albastru? Lumina Soarelui o vedem albă, însă ea este compusă din lumini (radiații) din cele șapte culori ale curcubeului, date de acronimul

Aerul reflectă culoarea albastră și de aceea vedem cerul albastru.
Importanța aerului pe Pământ
Oxigenul din aer întreține viața.
Stratosfera, care conţine stratul de ozon, absoarbe cea mai mare parte a radiaţiilor ultraviolete. Dacă ar pătrunde în totalitate până la suprafaţa terestră, aceste radiaţii ar distruge viaţa de pe planetă, deoarece temperatura ar crește foarte mult.
Arderea combustibililor.
Definiţie
Substanțele care poluează aerul și schimbă compoziția acestuia se numesc poluanți.
Poluanții sunt de două feluri:
a) Substanțe poluante naturale: compuși ai sulfului (din emanațiile vulcanice), compuși ai azotului și dioxid de carbon (din descompunerea resturilor vegetale și animale).
b) Substanțe poluante artificiale: compuși ai sulfului, ai azotului și ai carbonului, ozonul de la nivelul solului- rezultați în urma arderii combustibililor, proceselor industriale, folosirii de pesticide (omoară dăunătorii culturilor agrare).
Consecințele poluării aerului:
1) Poluarea aerului are efecte dăunătoare asupra sănătăţii oamenilor: bronşite acute şi cronice, crize de astm, boli cardiovasculare, alergii la polen, cancere pulmonare şi ale căilor respiratorii şi afecţiuni ale aparatului reproducător.

2) Majoritatea poluanților sunt „spălați” de către ploaie, zăpadă sau ceață și sunt transformați în acizi care se combină cu ploaia. Această ploaie acidă cade peste lacuri și păduri, unde poate duce la moartea peștilor sau plantelor și poate să afecteze întregi ecosisteme. Ploile acide pot să afecteze și sănătatea umană și obiecte create de oameni. Ele dizolvă încet statui istorice din piatră și fațadele monumentelor istorice.

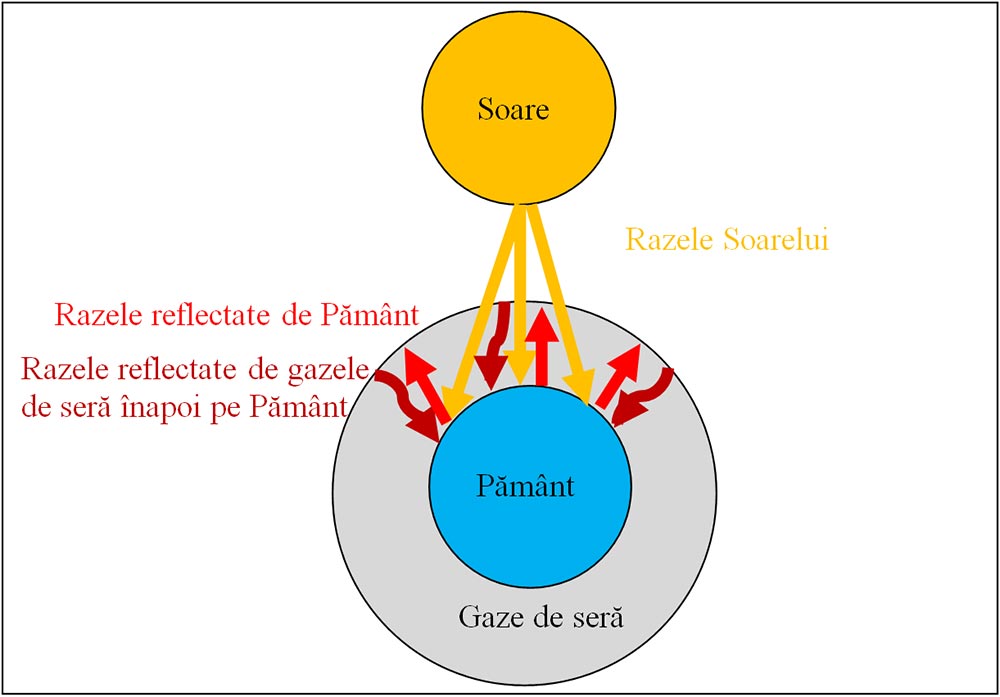
3) Una din cele mai mari probleme cauzate de poluarea aerului este încălzirea globală, o creștere a temperaturii Pământului . Ea este cauzată de acumularea unor gaze atmosferice, cum ar fi dioxidul de carbon și alte gaze, cunoscute sub denumirea de gaze de seră, care reduc căldura disipată de Pământ, dar nu blochează radiațiile Soarelui. Din cauza efectului de seră se așteaptă ca, temperatura globală să crească cu multe consecințe dezastroase:
schimbarea tiparul climatic,
afectarea producției agricole,
modificare distribuției animalelor și plantelor
creșterea nivelul mării.
2.5. Apa
Definiţie
Hidrosfera este învelișul de apă al Pământului , fiind formată din oceane, mări, lacuri, râuri, ape subterane, ghețari și reprezintă 70% din suprafața totală a planetei noastre.

Din toată apa existentă pe Pământ numai 3% este apă dulce, provenită din ghețari, ape subterane și alte surse (lacuri, atmosferă, sol).
Apa în natură se găsește în toate cele trei stări de agregare:
- solidă (zăpada, gheață);
- lichidă (oceane, mări, lacuri); -- gazoasă (vapori de apă din atmosferă).
Definiţie
Apa potabilă este apa bună de băut, care nu conține microorganisme sau substanțe toxice. Ea trebuie să aibă gust plăcut, fără miros, incoloră, fără impurități.
Observaţie
Cum devine apa din râuri potabilă ?
De exemplu Apa Nova care asigură apa potabilă în București parcurge următorii pași :
Pasul 1: Captarea apei: prelevează apă din cursul râurilor Argeș și Dâmbovița cu ajutorul mai multor prize de captare.
Pasul 2: Curățarea de deșeuri: la prima întâlnire, în dreptul bazinelor de captare, apa abundă în crengi, frunze, insecte și o mulțime de deșeuri, mari și mici, aduse de cursul râurilor. Mare parte dintre ele se opresc în grătarele de filtrare, primele instrumente responsabile pentru eliminarea deșeurilor.
Pasul 3: Îndepărtarea impurităților: în apa preluată există impurități invizibile ochiului liber. Pentru a le îndepărta, adăugă un coagulant care le obligă să se lipească una de alta sub formă de flacoane. Odată adunate pe fundul bazinului, flacoanele sunt mult mai ușor de colectat și retras din apă.
Pasul 4: Filtrarea: folosesc filtre cu nisip care rețin și elimină până la ultima particulă vizibilă de impuritate.
Pasul 5: Ozonarea:_ ozonul elimină bacteriile și virușii. În contact cu apa, ozonul descompune materiile organice și îmbunătățește considerabil culoarea și gustul acesteia.
Pasul 6: Clorinarea: se adăugă clor, în concentrații atent stabilite, atât la ieșirea apei din uzina de tratare, cât și în diferite puncte ale rețelei. Astfel, bacteriile sunt ținute la distanță, iar calitatea apei de-a lungul drumului ei către consumatori rămâne intactă.
Pasul 7: Stocarea și distribuția apei: apa este depozitează în rezervoare și transportată spre destinație, printr-o rețea formată din apeducte și conducte principale.
Rolul apei în organism
Apa este componenta principală a tuturor țesuturilor și organelor.
Lacrimile, saliva și transpirația conțin apă.
Necesarul zilnic de apă depinde de masa omului, de efortul depus și de climă.
Un om poate trăi minim trei zile fără apă.
Definiţie
Poluarea apei modifică compoziția apei și este o consecință a activităților umane din industrie, agricultură, gospodărie sau a unor procese naturale (erupții vulcanice, tsunami, alunecări de teren, inundații).
Poluarea apei poate fi:
- Poluare chimică cu metale, îngrășăminte chimice, pesticide, erbicide.
- Poluare fizică cu materiale plastice, deșeuri menajere.
- Poluare biologică cu bacterii, paraziți.
- Poluare radioactivă cu deșeuri radioactive de la centrale nucleare.
2.6. Soluții apoase. Dizolvarea.
Experiment
6. Ce este dizolvarea ?
Materiale necesare: pahar, apă, linguriță, sare extrafină.
Descrierea experimentului:
- Într-un pahar pune câteva cristale de sare fină și amestecă cu lingurița.
- Explică ce tip de amestec ai obținut și ce fel de fenomen (fizic/chimic) a avut loc.
Observaţie
Se observă în scurt timp cum cristalele parcă dispar și nu se mai văd în apă.
Concluzia experimentului:
S-a obținut un amestec omogen în urma unui fenomen fizic.
Definiţie
Dizolvarea este fenomenul fizic în urma căruia o substanță se răspândește uniform printre particulele altei substanțe, rezultând un amestec omogen.
Dizolvarea este o consecință a fenomenului fizic numit difuzie - de amestecare a două substanțe de la sine (fără intervenție din afară). La dizolvare intervenim din afară prin amestecare pentru a grăbi amestecarea.
Definiţie
Soluția este amestecul omogen de substanțe obținut în urma dizolvării.
important
Soluția este formată din două componente:
1) Dizolvat (solvat, solut) este substanța în cantitate mai mică. Ex: sarea, zahărul, piatra vânătă.
2) Dizolvant (solvent) este substanța în cantitate mai mare. Ex: apa, alcoolul, eterul, benzina, acetona.
Definiţie
Soluțiile în care dizolvantul este apa (cel mai utilizat dizolvant) se numesc soluții apoase.
Experiment
7. Conservarea masei unei soluții
Materiale necesare: pahar, apă, linguriță, sare fină, cântar.
Descrierea experimentului:
Cântărește 5g de sare fină.
Măsoară cu cilindrul gradat 50mL apă distilată, care cântărește 50g.
Amestecă sarea cu apa până la dizolvare și apoi cântărește soluția obținută.
Compară masa totală a componentelor cu masa soluției.
Ce observi?
Observaţie
Masa soluției = ms = msare + mapă
Concluzia experimentului:
Masa soluției este egală cu suma maselor dizolvatului și a dizolvantului.
Definiţie
Masele componentelor unei soluții se conservă (rămân aceleași).
Exemple de cele mai cunoscute soluții:
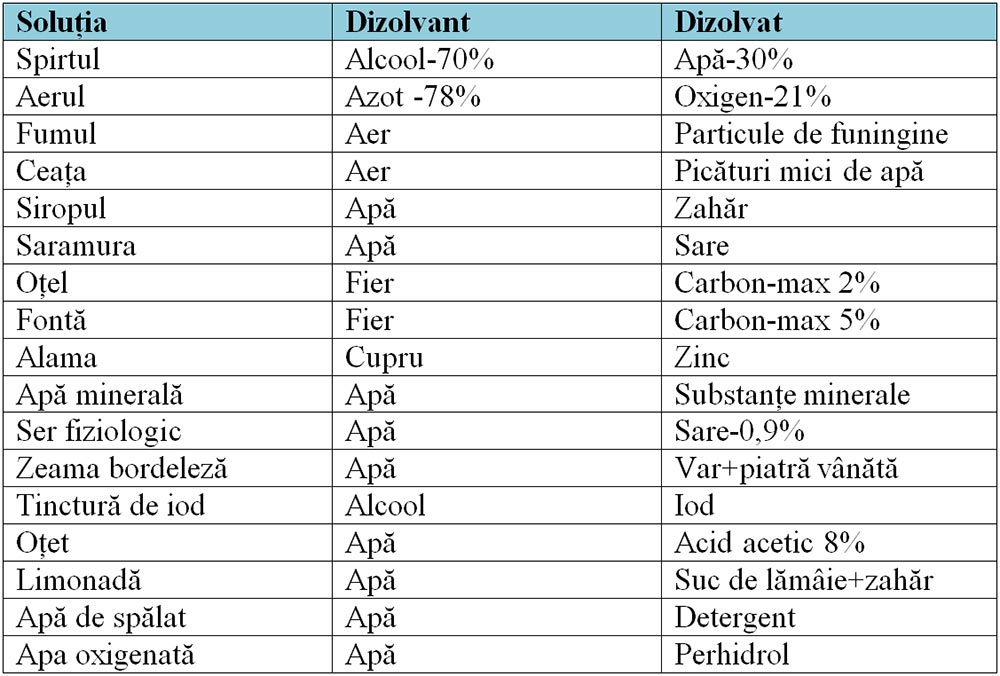
Zeama bordeleză
Este un pesticid cu acțiune fungicidă și algicidă. Se folosește pentru protejarea unor pomi fructiferi, printre care piersicii, caișii, prunii sau merii, dar și a viței de vie, a căpșunilor, cât și a unor legume – cartofi și roșii, de pildă. Pentru a prepara 100 de litri de zeamă bordeleză, cantitate suficientă pentru un hectar de vie pe rod, ai nevoie de: 1 kilogram de piatră vânătă, 1 kilogram de var stins, 100 de litri de apă.

Apa oxigenată
Este folosită ca cicatrizant, decolorant, antiseptic, hemostatic local.

Tincturile
Sunt soluții în care solventul este alcoolul (ex tinctură de iod, tinctură de propolis, etc).

Oțetul (lat. acetis)
Este acid acetic diluat în apă (3–9%), cu gust acru, produs prin fermentarea naturală acetică a vinului sau a sucului de mere.

Experiment
8. Factorii care influențează viteza de dizolvare a unei substanțe
Materiale necesare: sare grunjoasă, sare extrafină, cântar, spirtieră, trepied, baghetă, pahare Berzelius, sită, cilindru gradat, cronometru
Descrierea experimentului:
În 2 pahare pune câte 20mL apă și adaugă în fiecare 5 g sare grunjoasă, respectiv sare extrafină.
Amestecă și cronometrează timpul de dizolvare în fiecare caz.
Ce observi?
Observaţie
Dizolvarea are loc mai repede dacă dizolvatul are un grad mai mare de fărămițare(suprafața de contact este mai mare și particulelesunt mai mici).
- În 2 pahare pune câte 20mL apă și adaugă în fiecare 5g sare extrafină.
- Primul pahar pune-l pe sită și trepied, la încălzire.
- Cronometrează timpul de dizolvare în fiecare caz.
- Ce observi?
Observaţie
Dizolvarea are loc mai repede la temperaturi mai mari.
În 2 pahare pune câte 20mL apă și adaugă în fiecare 5g sare extrafină.
Primul pahar agită-l cu o baghetă, iar pe al doilea nu îl agita.
Cronometrează timpul de dizolvare în fiecare caz.
Ce observi?
Observaţie
Dizolvarea are loc mai repede dacă se agită componenții amestecului.
Concluzia experimentului:
Factorii care grăbesc dizolvarea unui solid într-un lichid sunt:
- dimensiune cât mai mică a particulelor (cristalelor)
- temperatură mai mare
- agitarea componentelor.
2.6.1. Aplică ce ai învăţat în legătură cu Soluțiile apoase şi Dizolvarea.
Temă
1. Patru pahare identice conțin fiecare câte 100 mL de apă. Se adaugă 10 g de zahăr în fiecare pahar.Tabelul prezintă informații despre fiecare pahar.
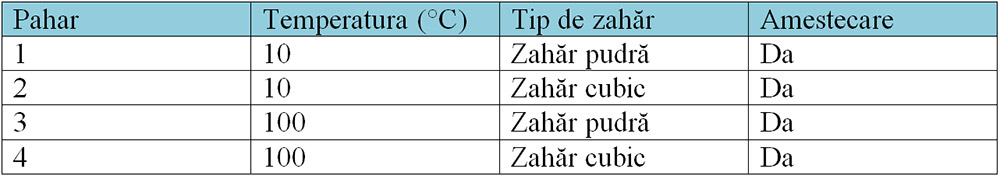
Aranjează paharele în funcție de viteza de dizolvare a zahărului, de la cel mai rapid la cel mai lent. Explică răspunsul!
2.7. Concentrația procentuală a soluțiilor
2.7.1. Clasificarea soluțiilor apoase
Definiţie
Solubilitatea este proprietatea unei substanțe de a se dizolva într-un anumit solvent.
important
Solubilitatea este o proprietate fizică măsurabilă, exprimată prin cantitatea maximă de substanță care se dizolvă în 100g de solvent, la o anumită temperatură.
important
Solubilitatea depinde atât de natura dizolvantului, cât și de natura dizolvatului.
Clasificarea substanțelor după solubilitatea în apă:
a) Substanțe ușor solubile au solubilitatea > 10g ex: piatra vânătă, sarea, zahărul
b) Substanțe greu solubile au solubilitatea < 10g, dar > 0,01g ex: carbonatul de magneziu, var stins, oxigenul, iodul
c) Substanțe insolubile au solubilitatea < 0,01g ex: metalele, sulful, cărbunele, uleiul, plasticul, etc.
Experiment
9. Solubilitatea substanțelor
Materiale necesare: 3 eprubete, apă, sare, ulei, hidroxid de calciu.
Descrierea experimentului:
Pune în cele 3 eprubete aceeași cantitate de apă și adaugă în fiecare aceeași cantitate de sare, în a doua ulei și în a treia hidroxid de calciu.
Agită-le.
Ce observi?
Observaţie
Sarea s-a dizolvat ușor, uleiul nu s-a dizolvat (adică este insolubil în apă) și hidroxidul de calciu s-a dizolvat parțial (mai greu).
Concluzia experimentului:
Unele substanțe se dizolvă ușor în apă (sarea), altele nu se dizolvă deloc (uleiul) și mai există substanțe care se dizolvă mai greu( hidroxidul de calciu).
Factorii care influenţează solubilitatea substanţelor:
- Natura solutului şi a solventului este un prim factor care influenţează solubilitatea substanţelor.
- Temperatura este un alt factor care influenţează solubilitatea substanţelor. În general, cu creşterea temperaturii, creşte solubilitatea substanţelor solide şi lichide şi scade solubilitatea gazelor.
- Presiunea influenţează solubilitatea gazelor. Cu creşterea presiunii, creşte solubilitatea substanţelor gazoase în solvenţii lichizi.
Clasificarea soluțiilor după masa de substanță dizolvată:
- Soluții nesaturate
- diluate: conțin o masă mică de dizolvat
- concentrate: conțin o masă mare de dizolvat
Soluții saturate: conțin masa maximă de dizolvat la o temperatură dată, fiind egală cu solubilitatea substanței respective.
Soluții suprasaturate: conțin mai multă cantitate de dizolvat decât solubilitatea acestuia la temperatura dată.
Experiment
10. Obținerea soluțiilor diluate, concentrate, saturate și suprasaturate
Materiale necesare: sare, pahare Berzelius, sită, trepied, spirtieră, chibrit, baghetă, piatră vânătă.
Solubilitatea unei substanțe este o constantă de material, piatra vânătă având 20,7g / 100g apă, la 20°C (vezi Anexa 1 de la sfârșitul manualului).
Descrierea experimentului:
Pentru a obține o soluție diluată în 100mL apă, adaug puțină piatră vânătă față de solubilitatea ei (5g) și o dizolv.
Pentru a obține o soluție concentrată în 100mL apă adaug mai multă piatră vânătă , dar mai puțin față de solubilitatea ei (15g) și o dizolv.
Pentru a obține o soluție saturată în 100mL apă adaug o cantitate de piatră vânătă egală cu solubilitatea ei (20,7g) și o dizolv.
Pentru a obține o soluție suprasaturată în 100mL apă adaug mai multă piatră vânătă față de solubilitatea ei (25,1g) și pentru a o dizolva o încălzesc în flacăra spirtierei și apoi o răcesc.
2.7.2. Concentrația procentuală de masă
Cum putem afla cum este o soluție ? Simplu, îi aflăm concentrația procentuală.
Definiţie
Concentrația procentuală de masă ( c ) reprezintă masa de substanță dizolvată în 100g soluție.
Dacă md = c și ms = 100, atunci obținem următoarea formulă de calcul a concentrației:

și ca să rămână c singur într-o parte a egalității, îl ducem pe 100 în dreapta.

unde md = masa dizolvatului, ms = masa soluției
Observaţie
a) Concentrația procentuală de masă ( c ) se exprimă în procente (%). Deci, o soluție de sare de concentrație 25% arată că 25g sare sunt dizolvate în 100g soluție și nu 100g apă ca la solubilitate.
b) O soluție se poate concentra prin:
Adăugare de solvat (dizolvat).
Îndepărtarea prin evaporare a unei mase de apă din soluție.
Adăugarea unei soluții de același tip, dar cu concentrație mai mare.
c) O soluție se poate dilua prin:
- Adăugare de apă.
- Adăugarea unei soluții de același tip, dar mai diluată.
Temă
1. Să calculăm concentrațiile soluțiilor de la experimentul 10.

Deci, toate soluțiile de piatră vânătă care au concentrații mai mari de 17,14% sunt soluții suprasaturate, la temperatura camerei de 20°C.
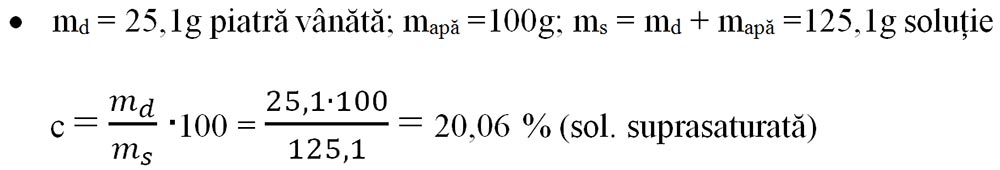
2.7.3. Probleme model cu concentrația procentuală de masă
Problemă model cu concentrația procentuală de masă
1) Determinarea masei de substanță dizolvată (md) când se dă masa soluției (ms) și concentrația acesteia (c)
Mama a preparat 400g sirop de concentrație 30%. Eu doresc să știu ce cantitate de zahăr, respectiv de apă a folosit mama.
ms = 400g sirop
c = 30%
md = ?
mapă = ?
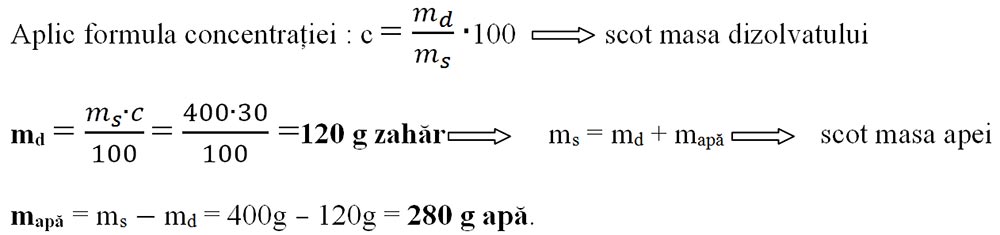
Problemă model cu concentrația procentuală de masă
2) Aflarea masei de soluție când se dă masa dizolvantului (md) și concentrația(c).
Maria dorește să prepare o saramură de concentrație 20%. Ea are la dispoziție 2kg de sare. Ce cantitate de saramură a obținut și câtă apă a folosit?
c = 20%
md = 2kg sare
ms =?
mapă = ?
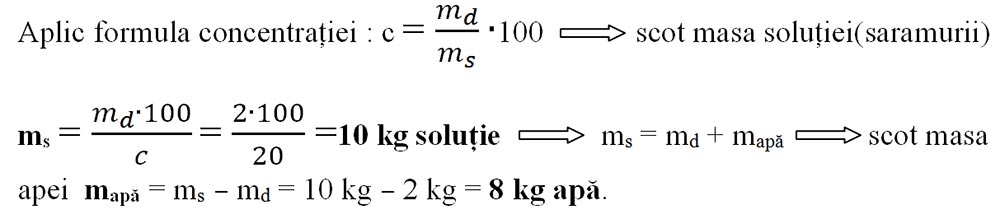
Problemă model cu concentrația procentuală de masă
3) Calculează masa de apă care trebuie evaporată din 30g soluție de sare de concentrație 10% pentru a ajunge la o concentrație de 30%. Știind că solubilitatea sării de bucătărie (clorură de sodiu) este de 36 g la 100g apă, precizează tipul celor două soluții, a celei inițiale și a celei finale.
ms1 = 30 g sol. sare
c1 = 10%
c2 = 30%
m apă evaporată =?

Deci, prima soluție este diluată, întrucât conține o cantitate mult mai mică decât solubilitatea ei.

Deci, a doua soluție este suprasaturată, întrucât conține o cantitate mai mare decât solubilitatea ei.
Problemă model cu concentrația procentuală de masă
4) Se amestecă 300g sirop de concentrație 20% cu 400g sirop de concentrație 30%. Ce concentrație va avea soluția obținută?
ms1 = 300 g sol. de zahăr
c1 = 20%
ms2 = 400 g sol. de zahăr
c2 = 30%
c = ?%

Problemă model cu concentrația procentuală de masă
5) Ce cantitate de apă trebuie adăugată la 80g soluție 40% de sare pentru a o dilua la 20% ?
ms1 = 80 g sol. de zahăr
c1 = 40%
c2 = 20%
mapă adăugată = ?

Problemă model cu concentrația procentuală de masă
6) Determină relația de legătură între solubilitatea (s) a unei substanțe și concentrația (c) a soluției saturate a acesteia.
La mapă = 100 g apă avem md = s
ms = md + mapă = s + 100

2.8. Sinteză recapitulativă - Substanțe, amestecuri de substanțe
important
Substanța pură are o compoziție bine determinată, are constante fizice specifice și își păstrează compoziția în urma unor fenomene fizice.
Pentru a exprima cât de curată este o substanță se folosește noțiunea de puritate.
Puritatea( p ) reprezintă masa de substanță pură care se găsește în 100g de substanță impură. Ea se exprimă în procente (%).
Amestecul este rezultatul punerii în comun a două sau mai multe substanțe între care nu au loc fenomene chimice (reacții chimice).
Amestecurile au următoarele caracteristici :
A) Un amestec este format din doi sau mai mulți componenți.
B) Substanțele componente pot fi luate în diferite proporții.
C) Fiecare substanță componentă își păstrează proprietățile fizice și chimice.
După compoziția lor, amestecurile se clasifică în :
1) Amestecuri omogene care au aceeași compoziție și aceleași proprietăți în toată masa lor.
Exemple de amestecuri omogene:
- soluții;
- aliaje;
- oțet;
- aer pur;
- spirt.
2) Amestecuri eterogene care nu au aceeași compoziție și aceleași proprietăți în toată masa lor și se observă cu ochiul liber sau cu lupa componenții săi.
Exemple de amestecuri eterogene:
- sare grunjoasă;
- apă cu nisip;
- aer cu praf sau fum;
- solul;
- roci.
Metode de separare a amestecurilor omogene
I.Cristalizarea este metoda de separare a unei substanțe solide sub formă de cristale dintr-un amestec omogen lichid (soluție), prin evaporarea substanței lichide.
Aplicațiile cristalizării :
Extragerea sării din apa de mare.
Extragerea zahărului din trestia/sflecla de zahăr.
II.Distilarea constă în separarea componentelor lichide dintr-un amestec omogen, pe baza punctelor lor de fierbere diferite. În timpul distilării au loc două fenomene fizice : vaporizarea, urmată de condensare.
Aplicațiile distilării:
Obținerea apei distilate (pură din punct de vedere chimic), folosită în laboratoare, industrie, farmacie.
Obținerea băuturilor alcoolice în instalații industriale cu alambic.
Prin distilarea fracționată a petrolului, în rafinăriile petrochimice se obțin propan, butan, benzine, petrol lampant, motorină, păcură.
Distilarea fracționată a aerului, cu separarea azotului de oxigen.
Metode de separare a componentelor unui amestec eterogen
I. Decantarea este metoda de separare a componentelor unui amestec eterogen solid – lichid sau lichid –lichid pe baza diferenței mari dintre densitățiile acestora.
a) Pentru componente solid-lichid având densități cu mult diferite, se folosește decantarea cu ajutorul baghetei (când solidul stă la fundul lichidului) .
b) Pentru componentele lichid-lichid cu densități diferite, se folosește pâlnia de separare.
Aplicațiile decantării :
Obținerea apei potabile în bazine decantoare de mari dimensiuni, în care impuritățile solide se depun pe fundul decantorului și apa se limpezește și se epurează(curăță) mecanic .
Separarea celor 2 componente ale varului stins : apa de var și laptele de var.
II.Filtrarea este metoda de separare a unei substanțe solide dintr-un amestec eterogen solid-lichid, cu ajutorul unui material filtrant.
Observație:
Când densitatea solidului este mult mai mare ca cea a lichidului din amestec, aplicăm decantarea, iar când densitatea solidului este asemănătoare cu cea a lichidului (solidul nu se depune la fundul lichidului, ci este peste tot împrăștiat prin lichid) , aplicăm filtrarea.
Aplicațiile filtrării:
Filtru pentru apă potabilă (bună de băut)
Filtru pentru aer (automobile, aer condiționat, aspiratoare, industriale pentru reținerea gazelor poluante, etc)
Filtru de ulei la automobile
Filtru de cafea
Solul – partea exterioară a scoarței terestre - este un amestec eterogen de materie organică ( rădăcini de plante, mici organisme, resturi de vietăți aflate în descompunere care formează humusul) și materie anorganică (roci, apă, oxigen, dioxid de carbon, azot).
Principalele tipuri de sol:
- solul nisipos,
- solul argilos,
- solul calcaros.
Aerul – amestec omogen care înconjoară Pământul - conține azot (nitrogen) molecular diatomic (N2) în proporție de 78 % , oxigen molecular diatomic (O2) -21 %, argon (Ar) (0,92 %), dioxid de carbon (CO2) -0,04 %, ozon sau oxigen triatomic (O3) și alte gaze, praf, fum, etc.

Hidrosfera este învelișul de apă al Pământului , fiind formată din oceane, mări, lacuri, râuri, ape subterane, ghețari și reprezintă 70% din suprafața totală a planetei noastre.
Dizolvarea este fenomenul fizic în urma căruia o substanță se răspândește uniform printre particulele altei substanțe, rezultând un amestec omogen.
Soluția este amestecul omogen de substanțe obținut în urma dizolvării.
Soluția este formată din două componente :
1) Dizolvat (solvat, solut) este substanța în cantitate mai mică. Ex: sarea, zahărul, piatra vânătă.
2) Dizolvant (solvent) este substanța în cantitate mai mare. Ex: apa, alcoolul, eterul, benzina, acetona.
Soluțiile în care dizolvantul este apa, cel mai utilizat, se numesc soluții apoase.
Masele componentelor unei soluții se conservă (rămân aceleași), adică masa soluției este egală cu suma maselor dizolvatului și a dizolvantului.
Exemple de cele mai cunoscute soluții:

Factorii care grăbesc dizolvarea unui solid într-un lichid sunt:
dimensiune cât mai mică a particulelor ( cristalelor )
temperatură mai mare
agitarea componentelor.
Solubilitatea este proprietatea unei substanțe de a se dizolva într-un anumit solvent. Solubilitatea este o proprietate fizică măsurabilă, exprimată prin cantitatea maximă de substanță care se dizolvă în 100g de solvent, la o anumită temperatură.
Solubilitatea depinde atât de natura dizolvantului, cât și de natura dizolvatului.
Clasificarea substanțelor după solubilitatea în apă:
a) Substanțe ușor solubile (piatra vânătă, sarea, zahărul).
b) Substanțe greu solubile (carbonatul de magneziu, var stins, oxigenul, iodul).
c) Substanțe insolubile (metalele, sulful, cărbunele, uleiul, plasticul, etc.).
Factorii care influenţează solubilitatea substanţelor :
Natura solutului şi a solventului este un prim factor care influenţează solubilitatea substanţelor.
Temperatura este un alt factor care influenţează solubilitatea substanţelor. În general, cu creşterea temperaturii, creşte solubilitatea substanţelor solide şi lichide şi scade solubilitatea gazelor.
Presiunea influenţează solubilitatea gazelor. Cu creşterea presiunii, creşte solubilitatea substanţelor gazoase în solvenţii lichizi.
Clasificarea soluțiilor după masa de substanță dizolvată :
- I. Soluții nesaturate
- diluate: conțin o masă mică de dizolvat
- concentrate: conțin o masă mare de dizolvat
II. Soluții saturate: conțin masa maximă de dizolvat la o temperatură dată, fiind egală cu solubilitatea substanței respective.
III. Soluții suprasaturate: conțin mai multă cantitate de dizolvat decât solubilitatea acestuia la temperatura dată.
Concentrația procentuală de masă ( c ) reprezintă masa de substanță dizolvată în 100g soluție.

unde md = masa dizolvatului,
ms = masa soluției = md + mapă
Observație :
a) Concentrația procentuală de masă ( c ) se exprimă în procente (%). Deci, o soluție de sare de concentrație 25% arată că 25g sare sunt dizolvate în 100g soluție și nu 100g apă ca la solubilitate.
b) O soluție se poate concentra prin:
Adăugare de solvat (dizolvat).
Îndepărtarea prin evaporare a unei mase de apă din soluție.
Adăugarea unei soluții de același tip, dar cu concentrație mai mare.
c) O soluție se poate dilua prin:
Adăugare de apă.
Adăugarea unei soluții de același tip, dar mai diluată.
2.9. Exerciții recapitulative - Substanțe pure și amestecuri de substanțe
Exerciții recapitulative - Substanțe pure și amestecuri de substanțe
1) Indică metoda de separare a componentelor următoarelor amestecuri și precizează felul amestecului:
a) Sirop
b) Apă cu pietricele
c) Spirt
d) Apă cu pulbere de carbon
e) Apă cu petrol
f) Saramură
g) Apă cu praf de cretă
h) Apă cu mercur
i) Apă cu pilitură de cupru
j) Tinctură de iod
k) Apă cu scoici
2) Precizează metoda de separare pentru următoarele aplicații:
a) Extragerea zahărului din trestia de zahăr.
b) Separarea zațului de cafea.
c) Obținerea apei potabile.
d) Separarea componentelor din petrol în rafinăriile petrochimice.
e) Extragerea sării din apa de mare.
f) Separarea oxigenului de azot din aerul atmosferic.
3) Răspunde cu adevărat (A) sau fals (F) la următoarele afirmații :
a) Dizolvarea unei substanțe într-un solvent este un fenomen chimic.
b) Soluția saturată conține o cantitate de dizolvat egală cu solubilitatea ei, la temperatură normală.
c) Dizolvantul este componenta în cantitate mai mare dintr-o soluție.
d) Dizolvantul se mai numește solvat.
e) Când se evaporă apa dintr-o soluție, se evaporă și dizolvatul.
f) O soluție se poate concentra prin adăugare de dizolvat.
g) O soluție se poate concentra prin adăugare de apă.
h) Concentrația procentuală de masă reprezintă cantitatea de substanță dizolvată în 100 g apă.
4) Scrieţi cele două componente şi denumirea lor pentru următoarele soluţii :
a) Ser fiziologic.
b) Oțel.
c) Sirop.
d) Limonadă .
e) Ceață.
f) Spirt .
g) Fum.
h) Aer .
5) Completează următoarele afirmații :
a) Soluțiile care conțin mai multă cantitate de dizolvat decât solubilitatea acestuia la temperatura dată se numesc………………………………….
b) Soluțiile diluate conțin o masă …………….de dizolvat.
c) Cu creşterea temperaturii, ………….. solubilitatea substanţelor solide.
d) Piatra vânătă este o substanță ………… solubilă în apă, iar fierul este o substanță………………….în apă.
e) ………………. este amestecul omogen de substanțe obținut în urma dizolvării.
f) Solvatul este componenta unei soluții în cantitate mai .....................
6) O soluție de piatră vânătă are concentrația procentuală de 30% și conține 20 g apă. Ce cantitate de piatră vânătă conține această soluție ?
7) 50 g soluție de apă oxigenată are concentrația procentuală de 12% . Ce cantitate de perhidrol este dizolvată în apă ? Dacă se adaugă 30 g soluție de apă oxigenată de concentrație 3%, care este concentrația soluției obținute ? Am concentrat soluția inițială sau am diluat-o ?
8) O saramură de concentrație 10% conține 40 g sare. O altă saramură de concentrație 40% conține 80 g sare. Ce concentrație are saramura obținută prin amestecarea celor două soluții ?
2.10. Model test chimie - Substanțe pure și amestecuri de substanțe
Model test chimie: SUBSTANȚE PURE ȘI AMESTECURI DE SUBSTANȚE
1) Precizaţi în dreptul fiecărei afirmaţii ce fel de amestec (omogen sau eterogen) reprezintă și scrieţi metoda de separare a componentelor. -2p
2) Denumește două aplicații ale cristalizării//distilăriifiltrării/decantării.-1p
3) Scrieţi cele două componente şi denumirea lor pentru anumite soluţii -1p
4) Completează definiția: Soluției, dizolvant, dizolvat, tipuri de soluții-1p
5) Problemă model: Ce concentrație are o soluție obținută prin dizolvarea a 20g sodă în 140g apă? Dacă adăugăm 30 g apă care este noua concentrație a soluției obținute ?-3p
Oficiu -2p