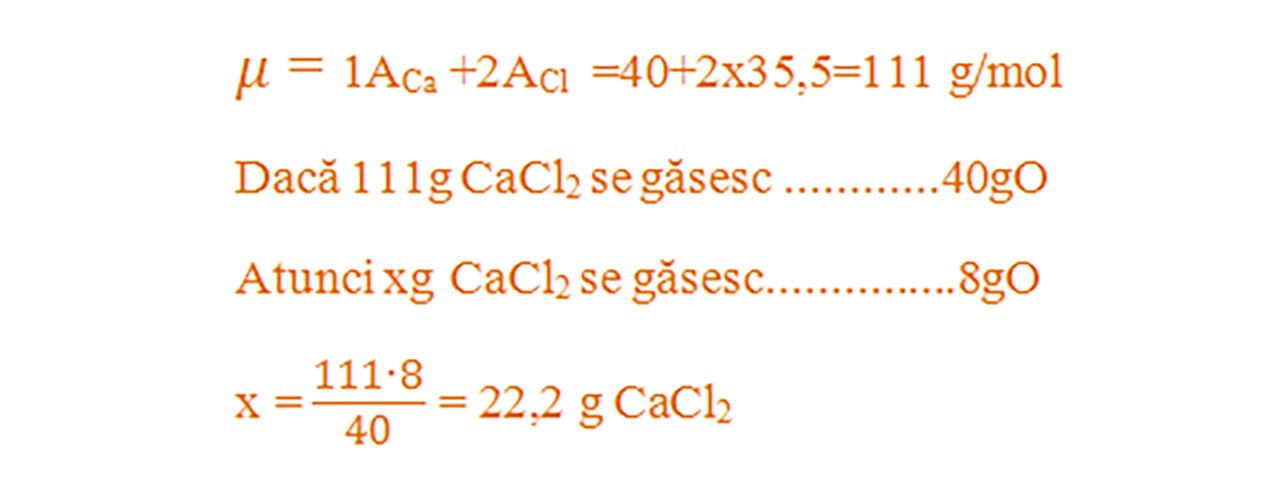I.RECAPITULAREA CHIMIEI DE CLASA a VII a
I.1. Noțiuni chimice importante. Puritatea. Concentrația procentuală de masă.
Definiţie
Puritatea (P) reprezintă masa de substanță pură care se găsește în 100g de substanță impură.
Exemplu de aplicare:
1) Din 800g sare grunjoasă se obține 700g sare pură. Calculați puritatea zăcământului și procentul impurităților.
800g sare impură..................700g sare pură
100g sare impură..................x g sare pură
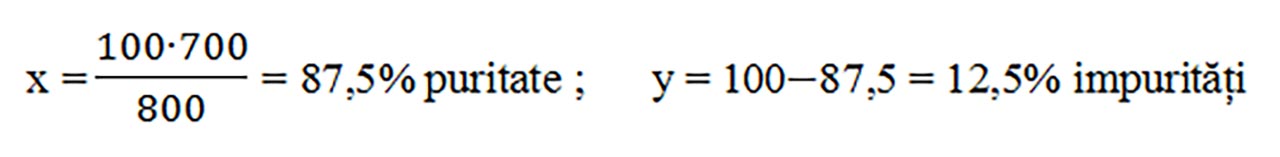
Definiţie
Concentrația procentuală de masă (c) reprezintă masa de substanță dizolvată în 100 g soluție.
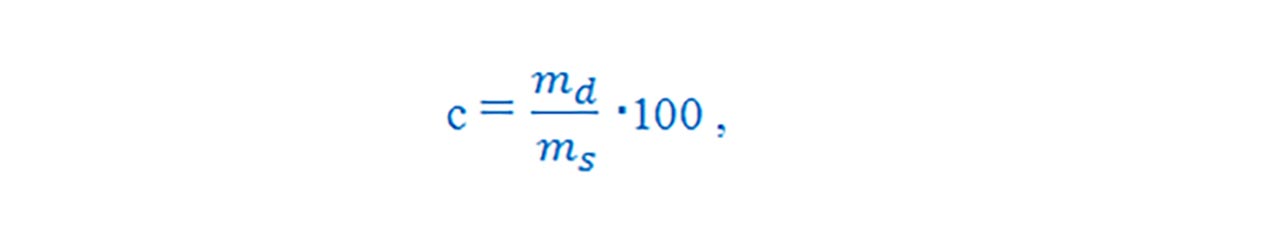
unde md = masa dizolvatului, ms = masa soluției
Exemplu de aplicare:
2) Mama a preparat 400g sirop de concentrație 30%. Eu doresc să știu ce cantitate de zahăr , respectiv de apă a folosit mama.
ms = 400g sirop
c = 30%
md = ?
mapă = ?
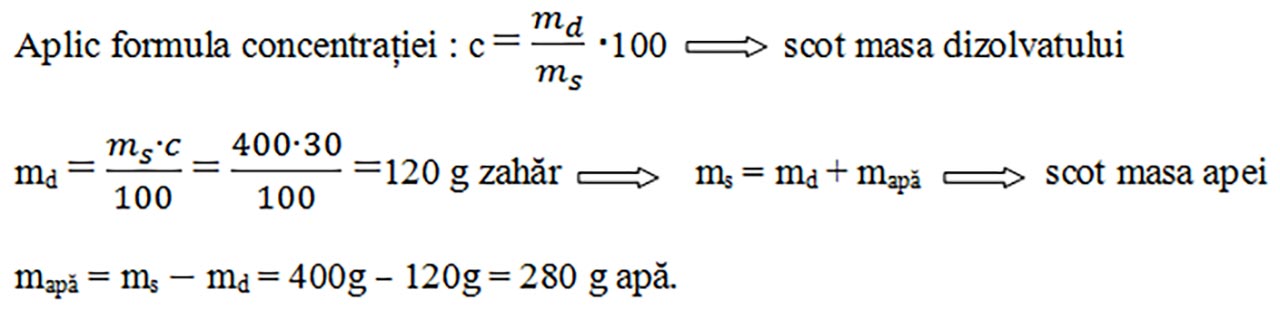
I.2. Structura atomului.
Definiţie
Atomul este cea mai mică particulă dintr-o substanță care nu mai poate fi divizat prin procedee chimice obișnuite.
important
Structura atomului:
1. Nucleul este partea centrală a atomului, alcătuit din particule numite nucleoni, și-anume:
- Protoni, particule încărcate cu sarcină pozitivă, cu simbolul p+1.
- Neutroni, particule neutre din punct de vedere electric şi simbolul n0.
2. Învelișul electronic este spațiul din jurul nucleului format dintr-un nor de particule numite electroni care gravitează în jurul nucleului. Electronii sunt particule cu sarcină negativă, masa electronului și simbolul e-1 sau ē.
Atomul este o particulă neutră din punct de vedere electric, deoarece are nr. protoni din nucleu (particule pozitive) egal cu nr electroni din învelișul electronic (particule negative), adică
nr. p+ = nr. ē
Definiţie
Pentru un atom definim numărul atomic, Z, care reprezintă numărul de protoni din nucleu care este egal cu numărul de electroni din înveliș. nr. p+ = nr. ē = Z.
Definiţie
Pentru orice atom se defineşte numărul de masă, A, care reprezintă numărul total de protoni şi neutroni din nucleul atomic. El reprezintă numărul întreg cel mai apropiat de masa atomică reală a speciei respective.
Definiţie
Numărul de neutroni din nucleu, N, se numeşte număr neutronic. N = A – Z
important
Ocuparea cu electroni a straturilor învelișului electronic:
a) Pentru stratul K, n=1, nr max ē = 2 x n2 =2 x 12 = 2 electroni
b) Pentru stratul L, n=2, nr max ē = 2 x n2 = 2 x 22 = 8 electroni
c) Pentru stratul M, n=3, nr max ē = 2 x n2 = 2 x 32 = 18 electroni
Cel mai folosit model de structură a învelișului electronic este modelul Bohr, în care straturile sunt cercuri concentrice cu nucleul la mijloc.
Exemplu de aplicare:
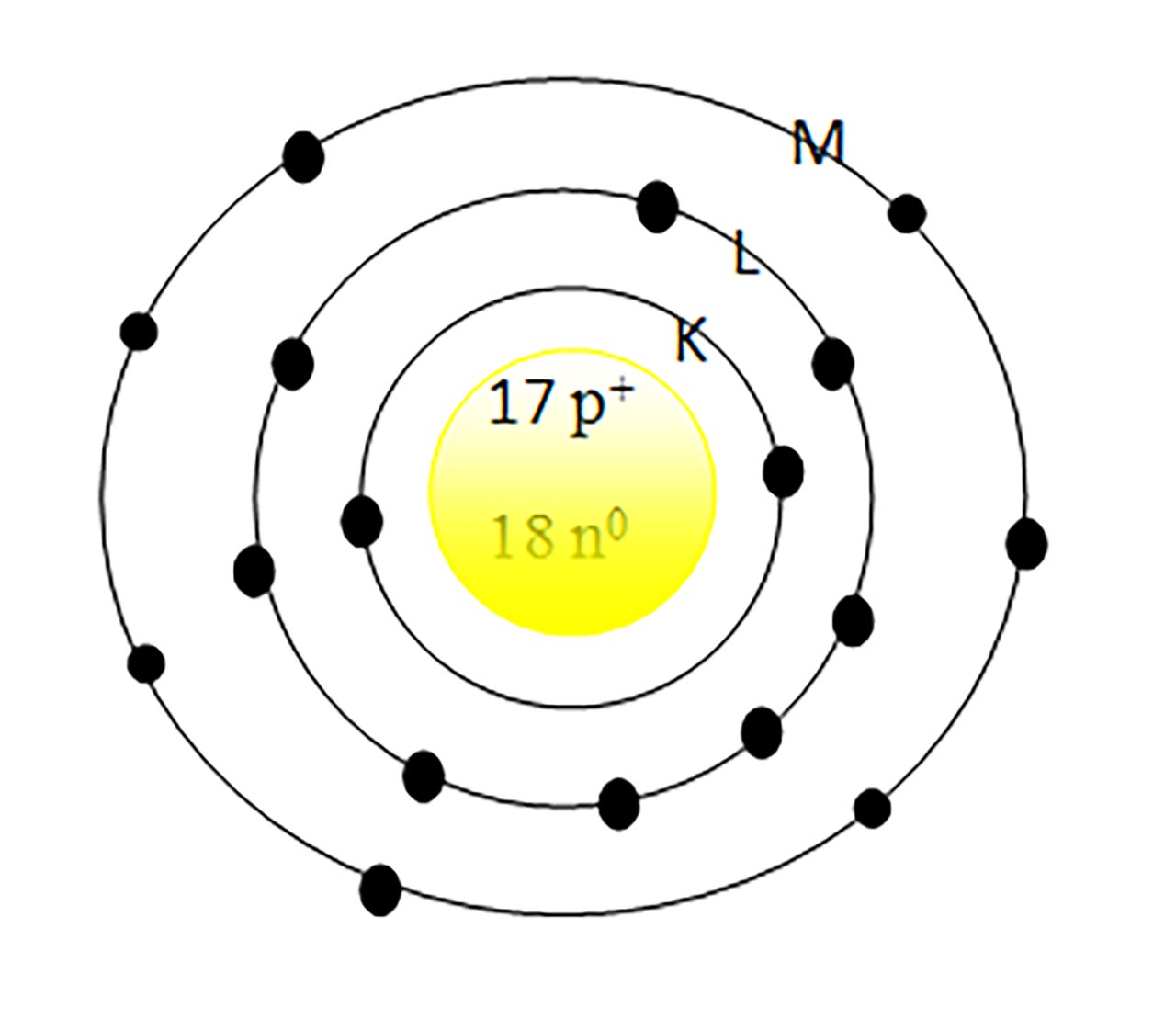
3) Reprezintă structura atomului de:
În mijloc reprezentăm nucleul cu protoni (Z = 17 = nr p+) și neutroni ( A - Z = 35 - 17 = 18 = nr n0)
În jurul nucleului:
Reprezentăm stratul 1 = K, cu max 2 ē
Apoi stratul 2 = L, cu max 8ē
Apoi stratul 3 = M, cu 7ē. În total trebuie să avem 17 ē, întrucât Z = 17 = nr. electroni din învelișul electronic.
I.3. Masa atomică relativă. Mol de atomi. Numărul lui Avogadro.
Definiţie
Masa atomică relativă (A) este numărul care arată de câte ori masa unui atom este mai mare decât unitatea atomică de masă (a 12-a parte din masa izotopului de carbon
).important
Masa atomică relativă medie este valoarea trecută în tabelul periodic în dreptul fiecărui element,şi este, de obicei, un număr raţional (a nu se confunda cu numărul de masă A care este un număr întreg).
Definiţie
Un mol de atomi reprezintă cantitatea, în grame, dintr-o substanţă simplă care conţine 6,022 x 1023 de atomi. Se mai numeşte şi atom gram. Se notează cu litera grecească ”niu”= υ.

Exemplu de aplicare:
4) Câți moli de atomi sunt cuprinși în 11,2g de Fe (AFe = 56) ?
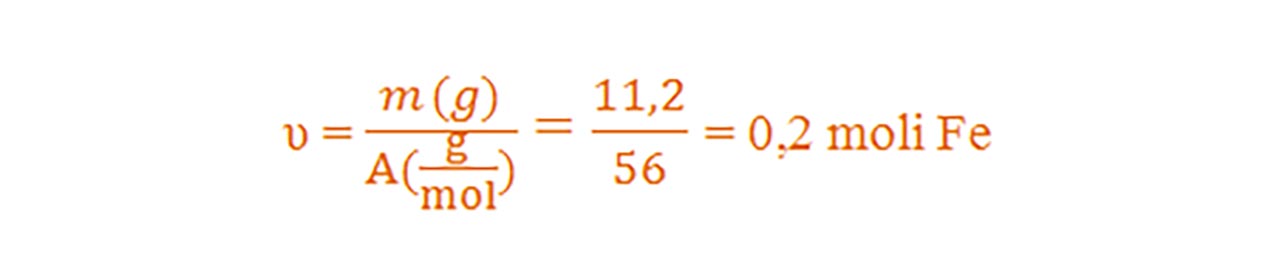
Definiţie
Numărul lui Avogadro, notat cu NA, este egal cu 6,022 x 1023 atomi şi reprezintă numărul de atomi conţinuţi într-un mol de atomi din orice element chimic.
I.4. Structura tabelului periodic. Metale. Nemetale.
important
Tabelul periodic este format din perioade și grupe.
Perioadele, notate cu litere arabe de la 1 la 7, sunt șiruri orizontale care conțin 2,8,18 sau 32 de elemente și fiecare perioadă se termină cu un gaz rar.
Grupele sunt coloanele verticale, în nr de 18 și se clasifică în:
1) Grupe principale notate cu cifre romane urmate de litera A (ex. IA-VIII A) sau cele cu cifre arabe 1,2,13,14,15,16,17,18 și conțin mai mult de 5 elemente.
2) Grupele secundare notate cu cifre romane urmate de litera B în nr de 10 (ex. IB-VIIIB, ultima fiind în nr de 3 grupe) sau cu litere arabe (3-12).
I.5. Metale. Nemetale.
important
În tabelul periodic avem două tipuri de substanțe simple:
Metale alcaline (gr.IA), alcalino-pământoase (IIA), pământoase (IIIA) și metale tranziționale (cele din grupele secundare) care se află sub linia îngroșată, în zig-zag.
Nemetale separate de metale printr-o linie îngroșată, în zig-zag (scăriță) și aflate deasupra acestei linii.
important
Numărul electronilor de pe ultimul strat al atomului este egal cu cifra unităților din nr grupei în care se află elementul.
Numărul perioadei în care se află un element este egal cu numărul stratului în curs de completare (ultimul strat) din structura electronică a atomului acelui element.
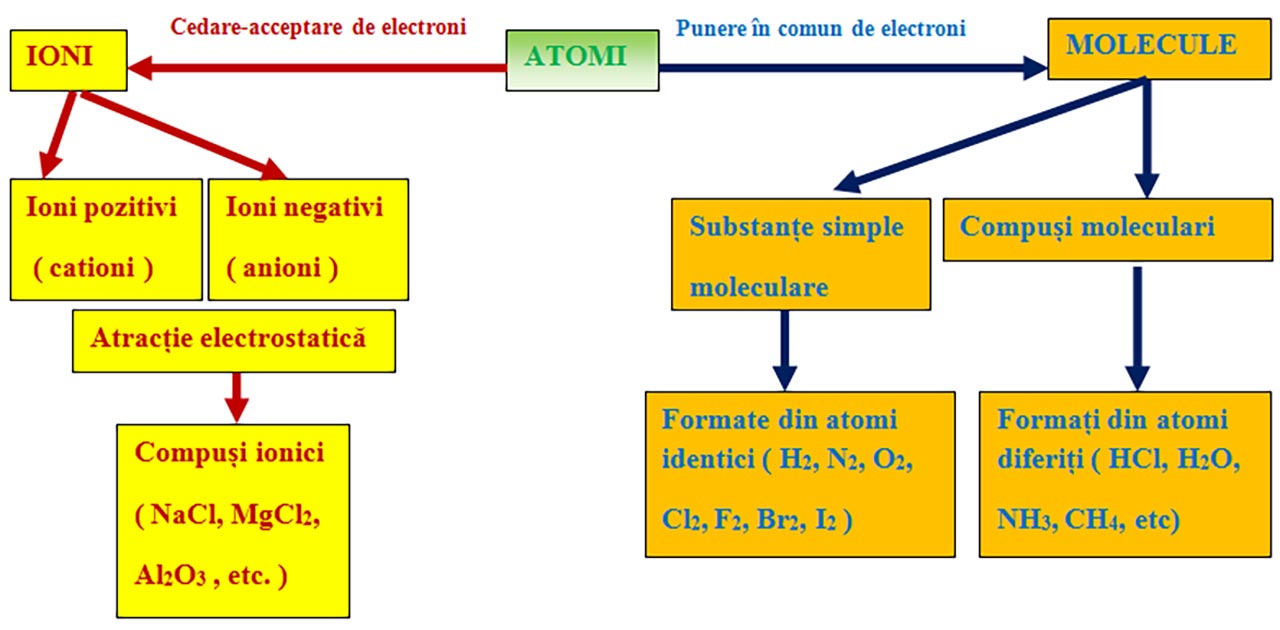
I.6. Formarea ionilor și a compușilor ionici.
Elementele chimice care se găsesc sub formă de atomi liberi stabili sunt cele șase gaze nobile ( rare) din grupa a VIII a A( sau grupa nr.18 ) a Tabelului periodic : Heliu(He), Neon(Ne), Argon(Ar), Kripton(Kr), Xenon(Xe) și Radon(Rn), având configurație stabilă a ultimului strat de dublet ( He ) sau octet ( celelalte gaze rare ).
Atomii celorlalte elemente se unesc între ei pentru a obține forme stabile, ioni sau molecule.
Definiție
Proprietatea carcteristică a atomilor de a se uni între ei se numește valență.
Definiție
Electronii periferici (de pe ultimul strat, numit strat de valență) care contribuie la formarea legăturilor dintre atomi se numesc electroni de valență.
Observație
Atomii metalelor, având un număr mic de electroni pe ultimul strat, cedează acești electroni și ajung la configurația stabilă a penultimului strat, identică cu cea a gazului rar precedent lui în Sistemul periodic.
important
Prin cedare de electroni, atomii metalelor devin ioni pozitivi ( cationi ), deoarece vor avea un surplus de protoni în nucleu. Spunem că metalele au un caracter electropozitiv.
Formarea ionilor pozitivi:
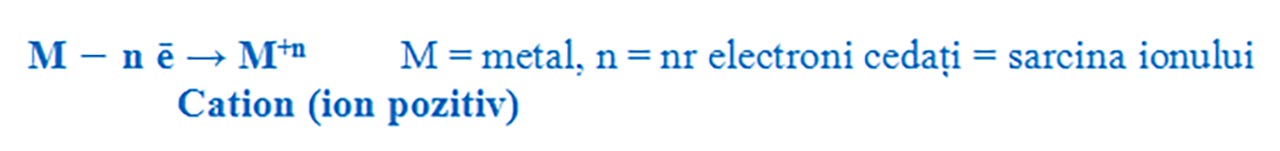
- Metalele din grupa 1 ( I A ) au 1 ē de valență pe care îl cedează, formând ioni pozitivi cu sarcina +1.

- Metalele din grupa a 2 a ( a II-a A ) au 2 ē de valență pe care îi cedează, formând ioni pozitivi cu sarcina +2.

- Metalele din grupa a 13 a ( a III-a A ) au 3 ē de valență pe care îi cedează, formând ioni pozitivi cu sarcina +3.

Observație
Atomii nemetalelor, având un număr mare de electroni pe ultimul strat, acceptă electroni pentru a forma octet stabil pe stratul de valență, identic cu cea a gazului rar ulterior lui în Sistemul periodic.
important
Prin acceptare de electroni, atomii nemetalelor devin ioni negativi ( anioni ), deoarece vor avea un surplus de electroni în înveliș. Spunem că nemetalele au un caracter electronegativ.
Formarea ionilor negativi:
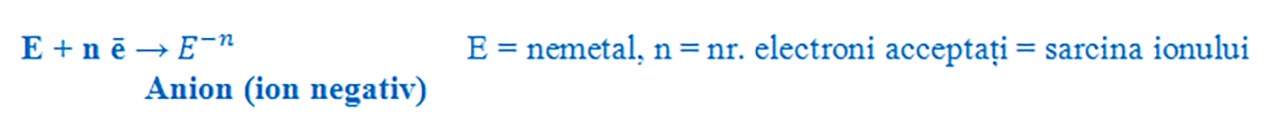
- Nemetalele din grupa a 15 a ( aVA ) au 5 ē de valență și trebuie să accepte 3 ē pentru a ajunge la configurația stabilă de octet, formând ioni negativi cu sarcina - 3.

- Nemetalele din grupa a 16 a ( aVIA ) au 6 ē de valență și trebuie să accepte 2 ē pentru a ajunge la configurația stabilă de octet, formând ioni negativi cu sarcina - 2.

- Nemetalele din grupa a 17 a ( a VIIA ) au 7 ē de valență și trebuie să accepte 1 ē pentru a ajunge la configurația stabilă de octet, formând ioni negativi cu sarcina - 1.

Definiție
Ionii sunt specii (particule) chimice încărcate cu sarcini electrice( deoarece numărul electronilor din înveliș este diferit de numărul protonilor din nucleu) provenite din atomi sau grupe de atomi, prin cedare sau acceptare de unul sau mai mulți electroni.
Nucleul ionului format este identic cu cel al atomului din care provine.
Definiție
Valența egală cu numărul electronilor cedați sau acceptați se numește electrovalență.

Denumirea ionilor:
Pozitivi (cationilor) : “ion de (numele metalului)”. Exemplu : ion de magneziu Mg(+2).
Negativi (anionilor) : “ion de (numele nemetalului) +terminația ” ură” . Exemplu : ion clorură Cl(-1). Pentru anionul O(-2) avem denumirea de “oxid de ”
Observație
Când ne referim la caracterul chimic al unui element, spunem ce este, adică metal sau nemetal.
Când ne referim la caracterul electrochimic al unui element, spunem ce fel de ioni formează, pozitivi sau negativi.
Prin urmare:
Metalele au caracter chimic metalic și caracter electrochimic electropozitiv.
Nemetalele au caracter chimic nemetalic și caracter electrochimic electronegativ.
important
Compușii ionici se formează în două etape:
Transfer de electroni ( ē ) de la metale la nemetale cu formarea ionilor pozitivi și negativi.
Atracția electrostatică între ionii de semn opus, fiind legătura chimică (legătură ionică) care se stabilește între ionii de semn contrar. Se formează un compus ionic stabil și neutru din punct de vedere electric (nr. sarcini pozitive = nr sarcini negative), întodeauna între două elemente cu caracter diferit (metale cu nemetale).
Exemple:
a) Sarea de bucătărie: Clorura de sodiu : NaCl
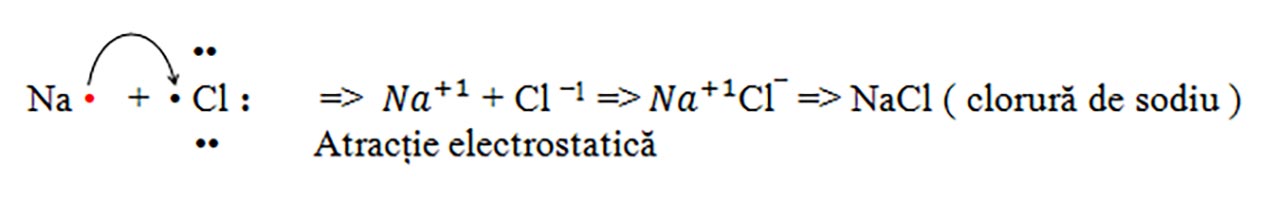
b) Clorura de magneziu : MgCl2
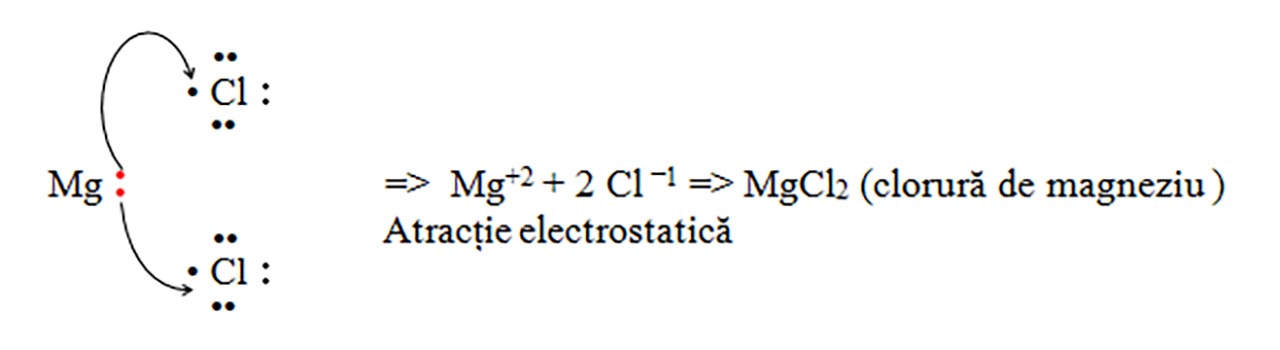
c) Clorura de aluminiu : AlCl3

I.7. Molecule. Formarea moleculelor.
Definiție
Atomii cu același caracter chimic (nemetalele) pot ajunge la configurația stabilă de dublet sau octet punând în comun electronii de valență și formând molecule.
Definiție
În molecule legătura obținută prin punerea în comun de electroni se numește legătură covalentă.
Definiție
Molecula reprezintă cea mai mică particulă dintr-o substanță, care poate exista și în stare liberă și care, păstrează proprietățile substanței din care provine.
important
Caracteristicile moleculelor:
Particule stabile
Particule electric neutre
Au forme și dimensiuni diferite
Între molecule există spații intermoleculare
Moleculele se mișcă dezordonat în funcție de temperatură
Moleculele aceleiași substanțe sunt identice
Reprezintă grupări de atomi identici sau diferiți.
Observație
I. După tipul atomilor care participă la formarea legăturii, aceasta poate fi:
1) Legatură covalentă nepolară prin punerea în comun de electroni între atomi identici. Se formează substanțe simple moleculare ( H2, N2, O2, F2, Cl2, Br2, I2 )
Exemple:
- a) formarea moleculei de hidrogen ( H2 ) :
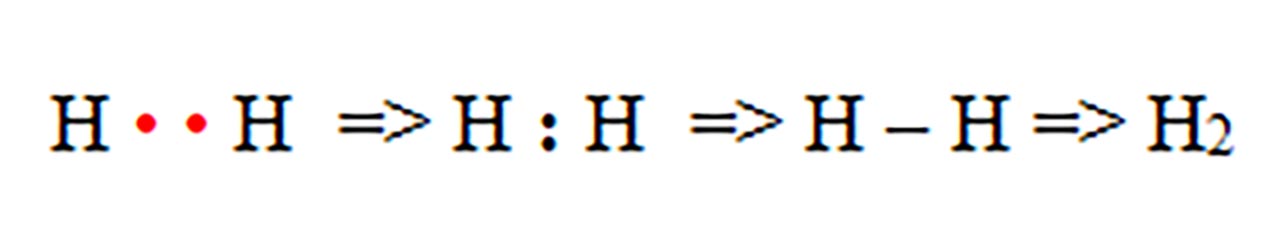
- b) formarea moleculei de clor ( Cl2 ) :
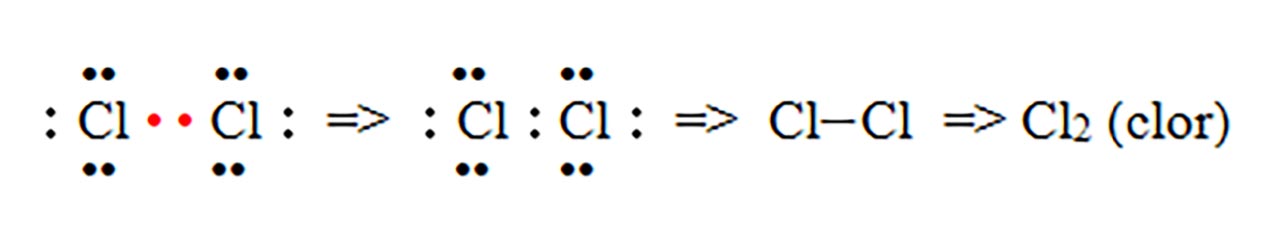
În mod identic se formează și moleculele de F2 (fluor), I2 (iod) și Br2 (brom).
- c) formarea moleculei de oxigen ( O2 ) :
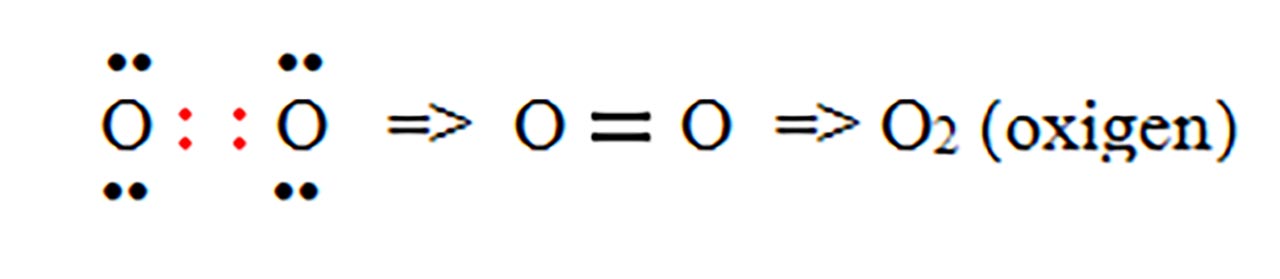
- d) formarea moleculei de azot ( N2 ) :
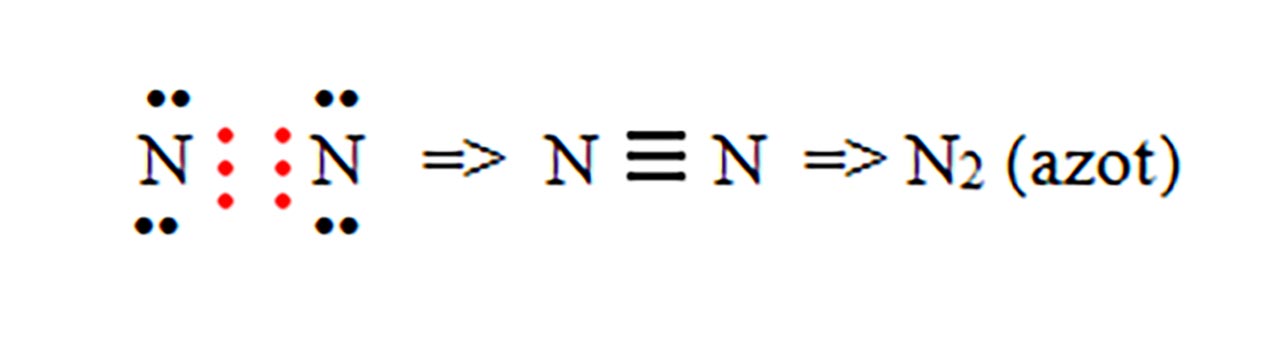
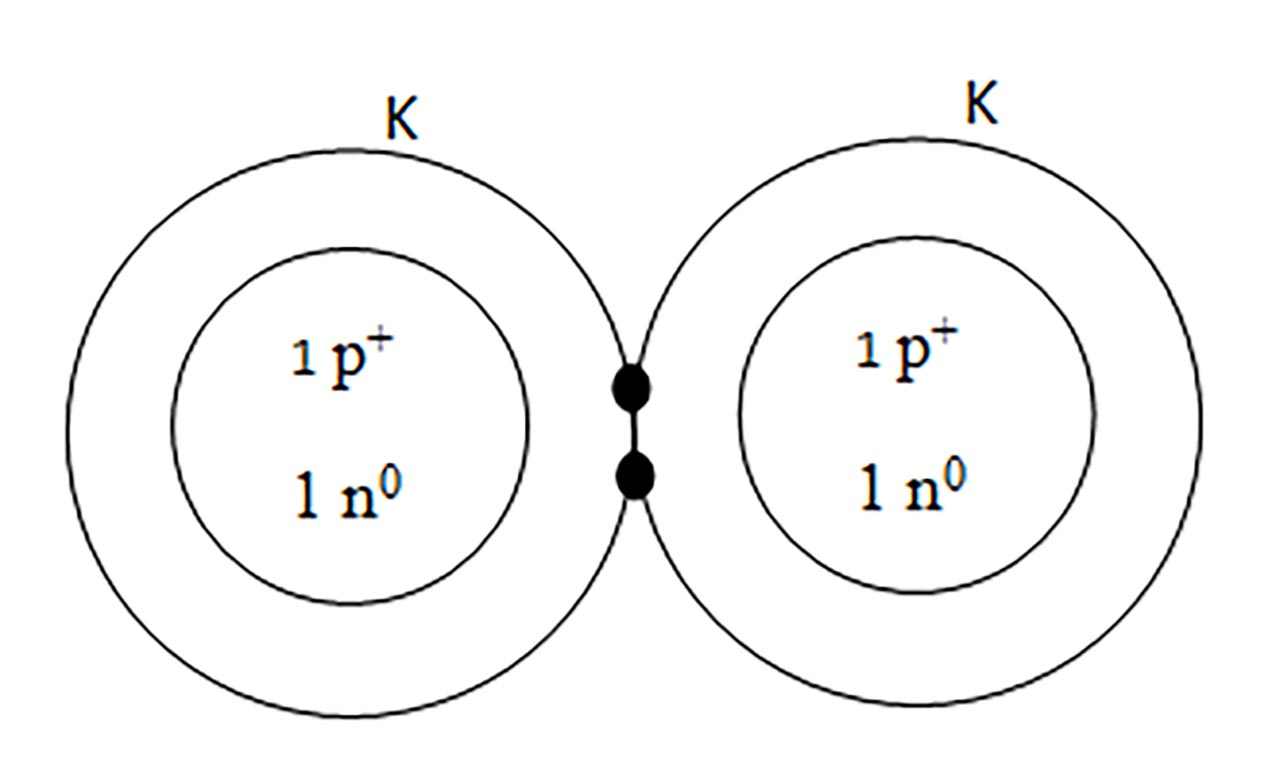
2) Legatură covalentă polară prin punerea în comun de electroni între atomi diferiti.
Exemple:
- a) formarea moleculei de acid clorhidric (HCl)
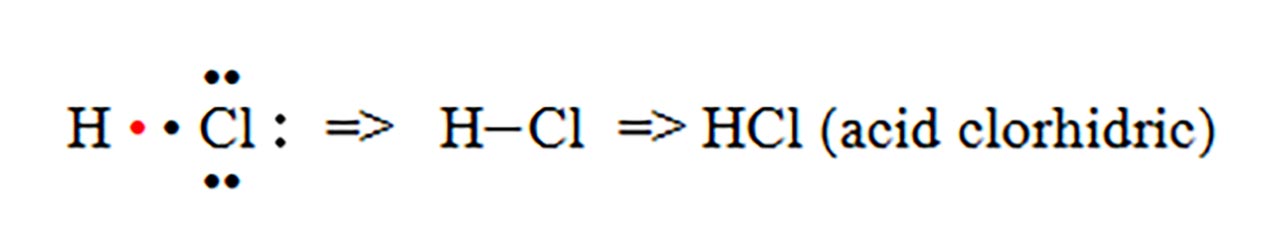
- b) formarea moleculei de apă (H2O)
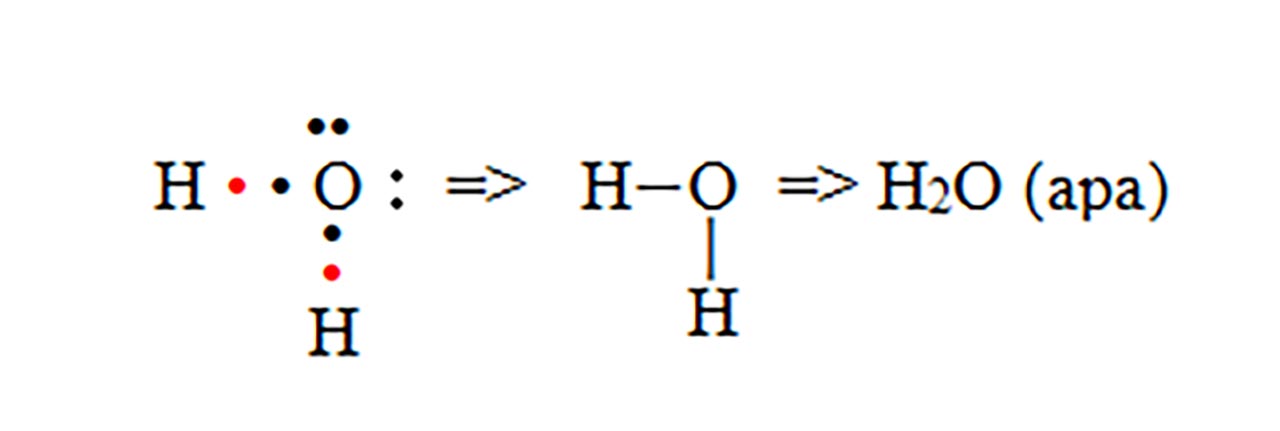
- c) formarea moleculei de amoniac (NH3)
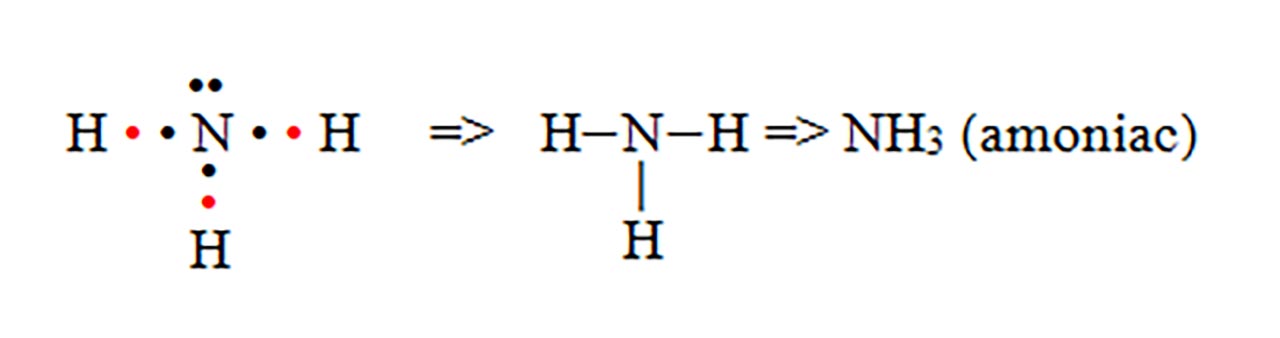
- d) formarea moleculei de metan (CH4)
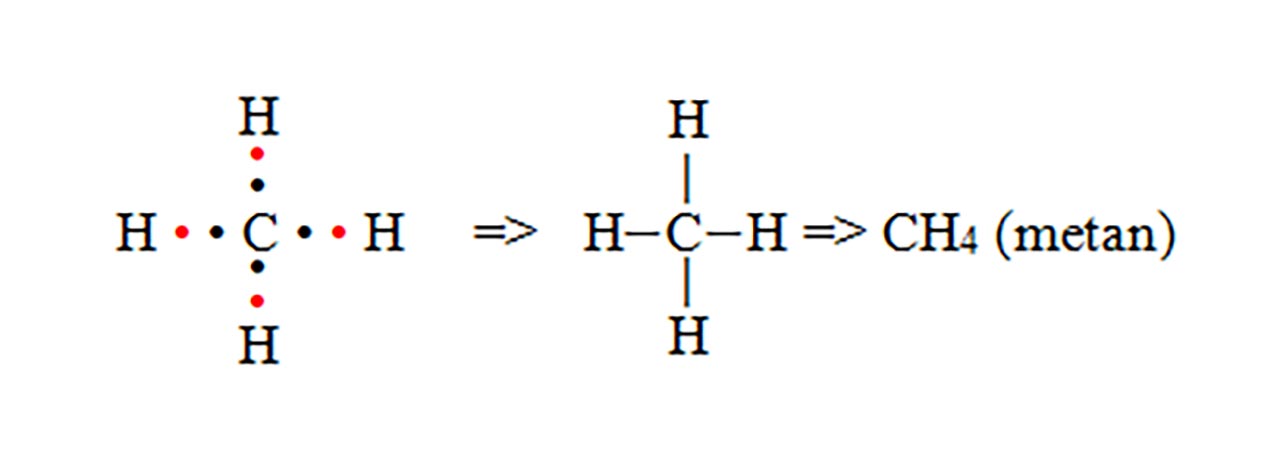
Observație
II.După numărul perechilor de ē puse în comun avem:

I.8. Scrierea formulelor chimice.
Definiție
Formula chimică reprezintă notarea moleculei cu ajutorul simbolurilor chimice ale elementelor componente și al indicelor, pentru a arăta numărul atomilor din fiecare element.
Indicele 1 nu se trece.
I. Pentru compuși binari (2 elemente diferite):
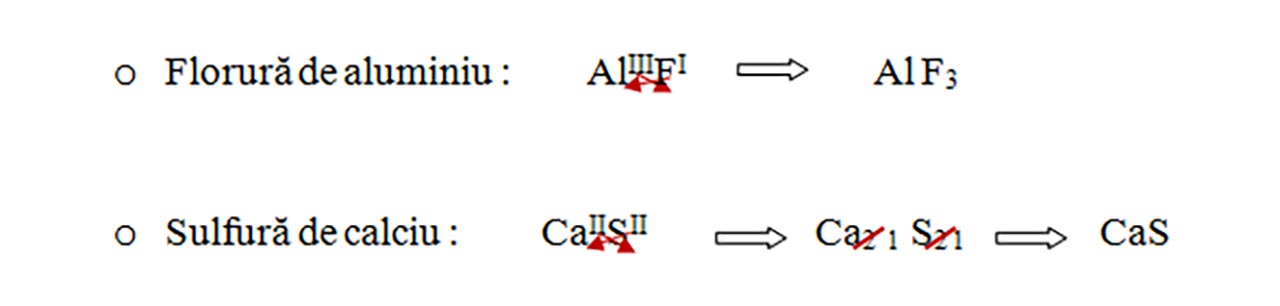
1) Se scriu simbolurile celor 2 elemente componente, primul al metalului, apoi al nemetalului .
2) După fiecare simbol se trece valența elementului cu cifre romane. În cazul în care valențele au un divizor comun se simplifică cu acel divizor.
3) Valența unui element se trece ca indice la celălalt element cu cifre arabe, astfel încât produsul dintre valența și indicele unui atom trebuie să fie egal cu produsul dintre valența și indicele celuilalt atom. Indicele egal cu 1 nu se trece.
Exemple:
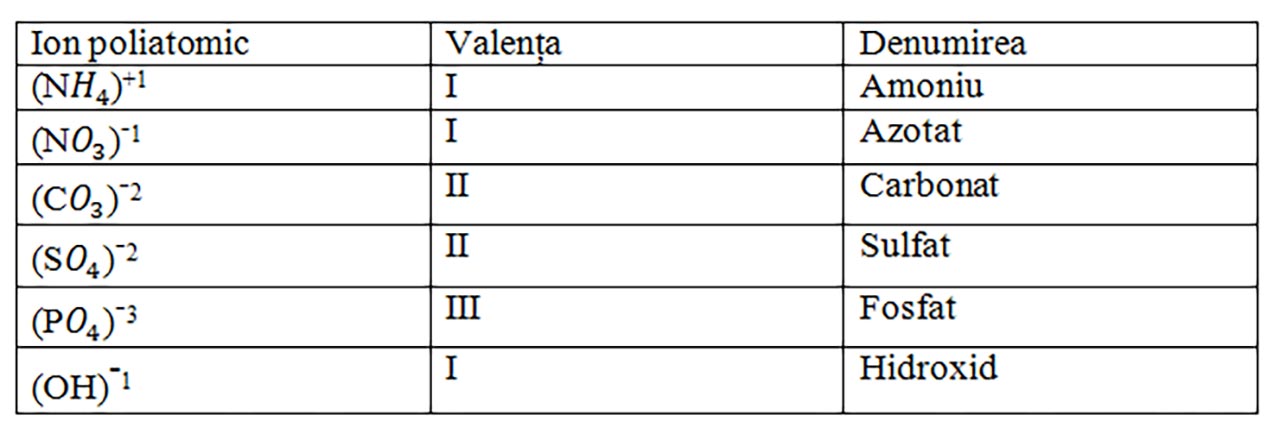
II. Pentru compuși ternari (3 elemente diferite): formați dintr-un ion metalic și ioni poliatomici:
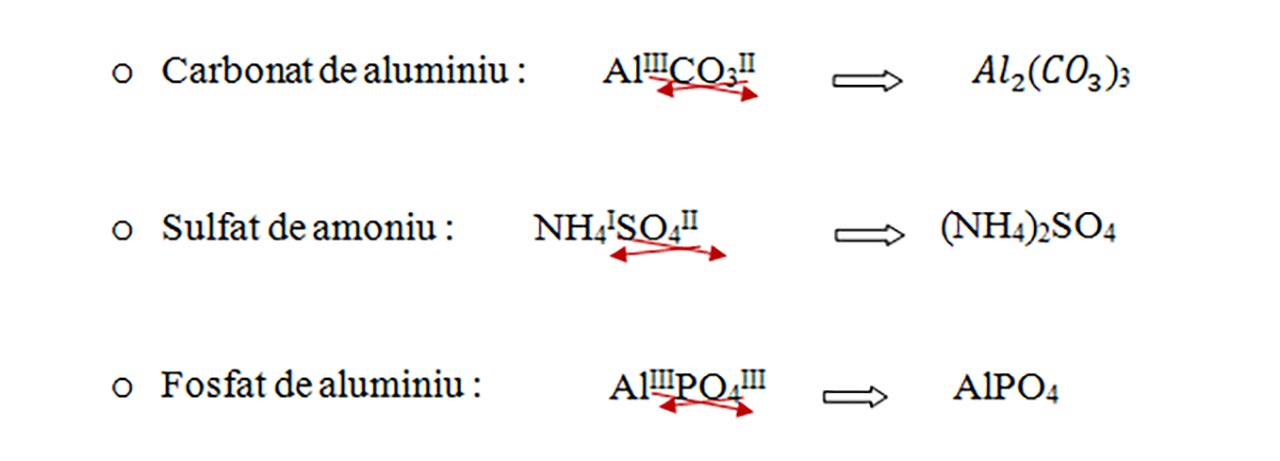
Exemple:
I.9. Compuși chimici anorganici.
important
Substanțe anorganice :
I. Substanțe simple: metale și nemetale (Unii atomi nu pot exista liberi și formează molecule biatomice, prin urmare, vom scrie H2, N2, O2, Cl2, F2, Br2, I2 )
II. Substanțe compuse (compuși chimici) care sunt:
1. Oxizi;
2. Baze;
3. Acizi;
4. Săruri.
I.9.1 Oxizi.
Definiţie
1) Oxizii sunt compuși binari ai oxigenului cu un element chimic (metal sau nemetal).
Formula generală: E2On , unde E = metal sau nemetal, n = valența elementului E
important
Clasificarea oxizilor după felul elementului :
a) Oxizi metalici: M2On se denumesc „oxid de denumire metal”:
- Oxid de calciu: CaO
- Oxid de sodiu: Na2O
- Oxid de aluminiu: Al2O3
- Oxid de fier II: FeO
Pentru oxizii metalici cu valență variabilă, se indică valența metalului.
b) Oxizii nemetalici se denumesc folosind prefixe care ne arată nr. atomilor de oxigen din componența lor sau a atomilor nemetalelor mai mare de unu:
- Monoxid de carbon: CO
- Dioxid de carbon: CO2
- Trioxid de sulf: SO3
- Trioxid de diazot: N2O3
- Pentaoxid de difosfor: P2O5
- Heptaoxid de diiod: I2O7
Exemplu de aplicare
5. Scrie formula următorilor oxizi și ce fel de oxid este (metalic/nemetalic):
a) Oxid de magneziu;
b) Pentaoxid de diazot;
c) Oxid de potasiu;
d) Dioxid de sulf.
Exemplu de aplicare
6. Scrie denumirea următorilor oxizi și ce fel de oxizi sunt:
a) Cl2O7
b) P2O3
c) Ag2O
d) CuO
I.9.2. Baze (Hidroxizi).
Definiţie
2) Bazele (hidroxizii) sunt substanțe compuse dintr-un ion metalic și una sau mai multe grupări hidroxid.
Formula generală: M(OH)n, unde M = metal și n = valența metalului
Denumirea bazelor: „hidroxid de denumire metal”
Hidroxid de mercur: Hg(OH)2
Hidroxid de calciu: Ca(OH)2
Hidroxid de fier III (feric): Fe(OH)3
Hidroxid de fier III (feros): Fe(OH)2
Când metalul are valență superioară se adaugă sufixul -ic, iar când are valență inferioară se adaugă sufixul -os.
Exemplu de aplicare
7. Scrie formula următorilor hidroxizi:
a) Hidroxid de magneziu
b) Hidroxid de sodiu
c) Hidroxid de zinc
d) Hidroxid de aluminiu
Exemplu de aplicare
8. Scrie denumirea următorilor hidroxizi:
a) KOH
b) Mg(OH)2
c) Cu(OH)2
d) Fe(OH)2
I.9.3. Acizi.
Definiţie
3) Acizii sunt substanțe compuse care conține hidrogen și un radical acid (nemetal sau grupare de nemetale).
important
Clasificarea acizilor:
A) Hidracizii sunt acizii formați din hidrogen și un nemetal. Denumirea lor se realizează astfel: „acid denumire nemetal-hidric”
- Acid clorhidric: HCl
- Acid fluorhidric: HF
- Acid sulfhidric: H2S
B) Oxiacizii sunt acizii formați din hidrogen și un radical acid (care conține un nemetal și oxigen). Denumirea lor se realizează astfel : „acid denumire nemetal-ic”
- Acid azotic : HNO3
- Acid carbonic : H2CO3
- Acid sulfuric : H2SO4
- Acid fosforic : H3PO4
Exemplu de aplicare
9. Scrie formula următorilor acizi și spune felul acidului (hidracid/oxiacid):
a) acid iodhidric
b) acid sulfuric
Exemplu de aplicare
10. Scrie denumirea următorilor acizi și spune felul acidului(hidracid/oxiacid):
a) HBr
b) H2S
c) H2CO3
d) H3PO4
I.9.4. Săruri
Definiţie
4) Sărurile sunt substanțe compuse care conțin un metal și un radical acid (nemetal sau grupare de nemetal co oxigen).
important
Clasificarea sărurilor :
A) Săruri provenite de la hidracizi prin înlocuirea hidrogenului cu un metal. Denumirea lor: „denumire nemetal-ură de denumire metal”.
- Bromură de calciu: CaBr2
- Sulfură de aluminiu: Al2S3
B) Săruri provenite de la oxiacizi prin înlocuirea hidrogenului cu un metal. Denumirea lor: „denumire nemetal-at de denumire metal”.
- Sulfat de calciu : CaSO4
- Azotat de mercur : Hg(NO3)2
Exemplu de aplicare
11. Scrie formula următoarelor săruri și spune felul lor, adică provenite de la un hidracid/oxiacid:
a) iodură de zinc
b) fosfat de calciu
Exemplu de aplicare
12. Scrie denumirea următoarelor săruri și spune felul lor:
a) KBr
b) Na2S
c) Ag2CO3
d) AlPO4
I.10. Calcule pe baza formulei chimice. Masa moleculară. Masa molară.
Molecula fiind formată din atomi, are dimensiuni foarte mici și masă foarte mică.
important
Masa moleculară este o mărime adimensională (un număr), care ne arată de câte ori este mai mare masa reală a unei molecule decât unitatea atomică de masă ( u.a.m.) Ea se calculează ȋnsumând masele atomice relative ale tuturor atomilor moleculei.
Exemplu
Masa moleculară a apei (H2O) este MH2O = 2 AH + 1 AO = 2 + 16 = 18
important
Masa molară (notată cu litera grecească miu = μ) este masa unui mol de substanță. Are ca unitate de măsură g/mol.
Masa molară este egală cu masa moleculară a substanței și conține NA particule ( numărul lui Avogadro = 6,022 ∙ 1023 particule – atomi sau molecule).
Exemplu
Masa molară a fosfatului de magneziu : Mg3(PO4)2 :
μ = 3AMg +2AP + 8AO =3∙24 + 2∙31 + 8∙16 = 72 + 62+ 128 = 262 g/mol
I.10.1. Compoziția procentuală de masă
Știind formula chimică a unei substanțe, se poate determina compoziția procentuală de masă.
Definiție
Compoziția procentuală de masă reprezintă masa fiecărui element conținută în 100g substanță.
Pornind de la formula chimică, se calculează masa molară și apoi cu regula de trei simplă se calculează procentul fiecărui element component.
Exemplu
Pentru acidul sulfuric- H2SO4 :
μ = 2AH + 1AS + 4AO = 2 + 32 + 64= 98 g/mol
Dacă 98g H2SO4conțin.........2gH........32gS........64gO
Atunci 100g H2SO4 conțin ....xgH.......ygS..........zgO.
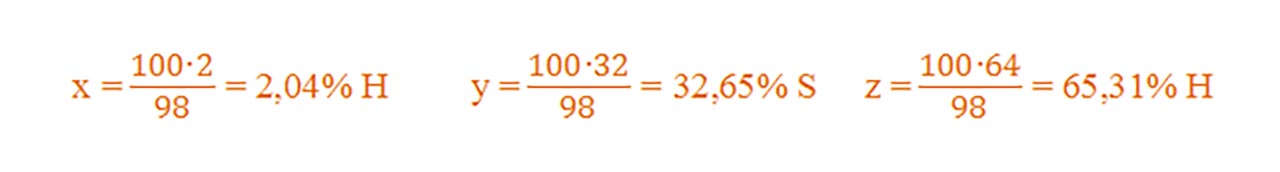
I.10.2. Raportul atomic al elementelor componente.
Definiție
Raportul atomic al elementelor componente este raportul între numărul de atomi din fiecare element component al substanței respective.
Pentru o substanță XaYbZc, raportul atomic este a : b : c
Exemplu
Apa – H2O are raportul atomic : 2H:1O
Acid azotic- HNO3 are raportul atomic : 1H:1N:3O
Sulfatul de fier III- Fe2(SO4)3 are raportul atomic : 2Fe:3S:12O
I.10.3. Raportul de masă.
Definiție
Raportul de masă este raportul între masele din fiecare element component al substanței respective.
Pentru o substanță XaYbZc, raportul de masă este aAX:bAY:cAZ
Exemplu
Apa – H2O are raportul de masă : 2AH:1AO = 2:16 = 1:8
Acid azotic- HNO3 are raportul de masă : 1AH:1AN:3AO=1:14:48
Sulfatul de fier III- Fe2(SO4)3 are raportul de masă : 2AFe:3AS:12AO=112:96:192 = 7:6:12
I.10.4. Masa unui element aflată într-o anumită masă de substanță compusă.
important
Masa unui element aflată într-o anumită masă de substanță compusă se determină pornind de la formula chimică, se calculează masa molară a substanței compuse și apoi cu regula de trei simplă, se calculează masa fiecărui element component aflată în masa dată de substanță compusă.
Exemplu de aplicare
13) Ce masă de oxigen se află în 27,2g apă oxigenată- H2O2 ?
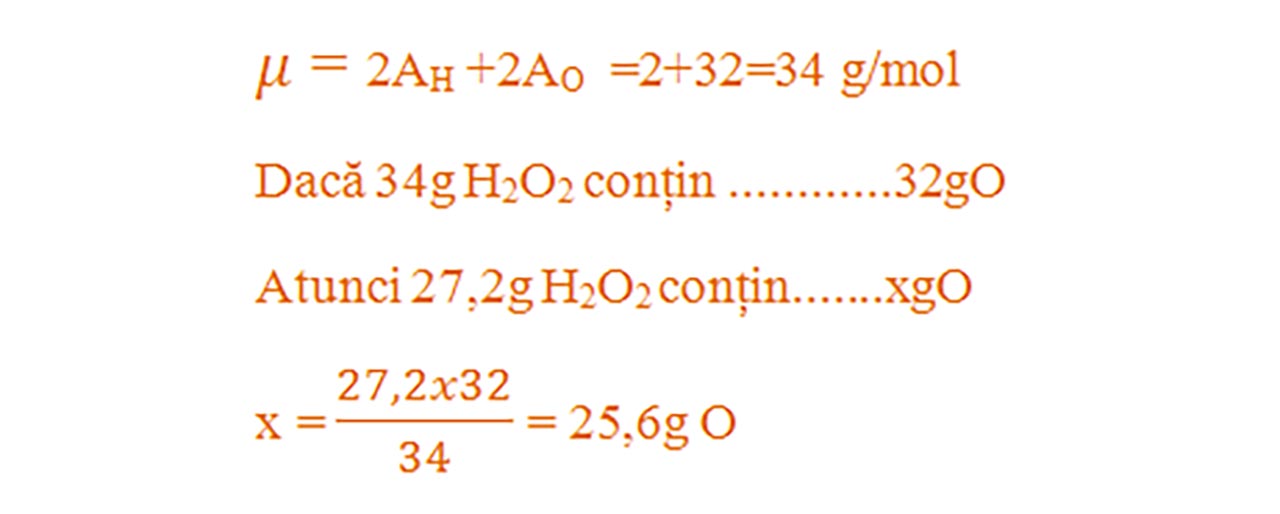
I.10.5. Masa unui substanțe compuse care conține o anumită masă de element.
important
Masa unui substanțe compuse care conține o anumită masă de element se determină pornind de la formula chimică, se calculează masa molară a substanței compuse și apoi cu regula de trei simplă se calculează masa de substanță compusă aflată într-o anumită masă de element chimic.
Exemplu de aplicare
14) Ce masă de clorură de calciu- CaCl2 se află 8g de calciu ?