IV.TIPURI DE REACȚII CHIMICE. REACȚIA DE DESCOMPUNERE.
IV.1. Reacția de descompunere
Știind că următoarele două reacții sunt reacții de descompunere, descoperă caracteristica comună a celor două reacții:
CuCO3 = CuO + CO2 ↑
AgCl = Ag ↓ + Cl2 ↑
Observăm că avem un reactant și doi produși de reacție.
Definiţie
Reacția de descompunere este reacția în care avem un singur reactant și mai mulți produși de reacție.
important

- Reactantul (A ) este întotdeauna o substanță compusă.
- Produșii reacției (B și C) pot fi atât substanțe simple, cât și substanțe compuse.
important
Ca tipuri de reacții de descompunere avem:
- Reacția de descompunere termică (prin încălzire ) a unor carbonați, hidroxizi, oxizi, etc.
- Reacția de descompunere electrolitică (cu ajutorul curentului electric).
- Reacția de descompunere catalitică (cu ajutorul unui catalizator, care nu participă la reacție, doar mărește viteza reacției ; el se regăsește în întregime în produșii de reacție).
- Reacția de descompunere la lumină a halogenurilor de argint.
Experiment
1. Descompunerea acidului carbonic (sifonului)
Materiale necesare: apă carbogazoasă (sifon), hârtie de turnesol (de pH), paste.
Descrierea experimentului:
Desfă dopul unei sticle de 0,5 L și introdu în apa carbogazoasă o hârtie de turnesol și câteva paste.
Ce observi ?
Observaţie
Apa carbogazoasă înroșește hârtia de turnesol, iar pastele sunt antrenate într-o mișcare continuă în apă.
Concluzia experimentului:
Apa carbogazoasă (sifonul) este acid carbonic și de aceea înroșește hârtia de turnesol.
Acidul carbonic se descompune în apă și dioxid de carbon.
Această reacție este reversibilă (poate avea loc în ambele sensuri).
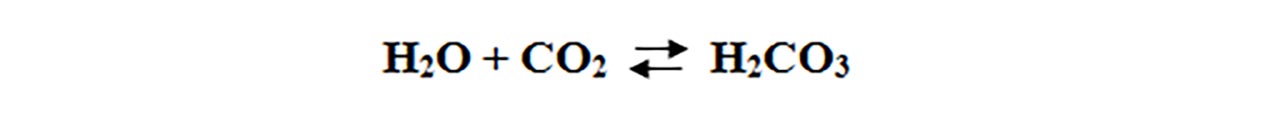
Aplicaţii
Reacția de descompunere este importantă, întrucât se obțin substanțe chimice cu multe utilizări :
- var nestins – CaO;
- oxigen – O2;
- hidrogen – H2;
- clor – Cl2;
- mercur - Hg;
- unele metale – Al, etc.
Calcarul (piatra de var ) - CaCO3 se descompune în cuptoare speciale, la temperaturi de 1000°C , obținându-se, la scară industrială, varul nestins (CaO), care este unul dintre cele mai importante materiale de construcții.
IV.2. Reacția de descompunere termică.
Experiment
2. Descompunerea carbonatului de cupru
Materiale necesare: creuzet, carbonat de cupru, spirtieră, trepied, sită de azbest chibrit, spatulă, eprubetă.
Atenție
Atenție când lucrezi cu surse de foc !
Descrierea experimentului:
Pune în creuzet un vârf de spatulă de carbonat de cupru.
Așază creuzetul pe sita de azbest cu trepied și încălzește-l la flacăra spirtierei.
După puțin timp, mută carbonatul de cupru într-o eprubetă și continuă încălzirea lui în flacără. Vino cu un băț de chibrit aprins deasupra eprubetei.
Ce observi ?
Observaţie
Prin încălzire, carbonatul de cupru verzui se transformă într-un solid negru, iar gazul degajat stinge flacăra chibritului.
Concluzia experimentului:
Carbonatul de cupru se descompune termic cu formare de oxid de cupru II – CuO , de culoare neagră și dioxid de carbon – CO2, care stinge flacăra. Este o reacție de descompunere, întrucât avem un singur reactant:
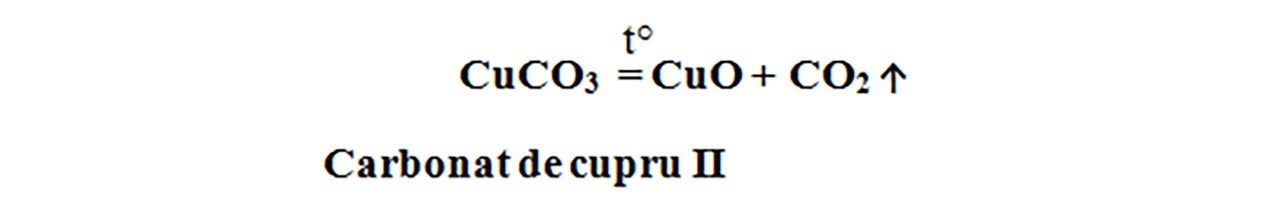
Experiment
3. Descompunerea hidroxidului de cupru
Materiale necesare: creuzet, hidroxid de cupru, spirtieră, trepied, sită de azbest chibrit, spatulă, pahar Berzelius.
Atenție
Atenție când lucrezi cu surse de foc !
Descrierea experimentului:
- Pune în creuzet un vârf de spatulă de hidroxid de cupru.
- Așază creuzetul pe sita de azbest și încălzește-l la flacăra spirtierei.
- Când aproape tot hidroxidul s-a înnegrit, pune deasupra creuzetului un pahar Berzelius uscat.
- Ce observi ?
Observaţie
Prin încălzire, hidroxidul de cupru verde-albastrui se transformă într-un solid negru și pe pereții paharului apar picături de apă.
Concluzia experimentului:
Hidroxidul de cupru, la cald , se descompune și formează oxidul de cupru II – CuO , de culoare neagră și vapori de apă – H2O, care se condensează pe pereții paharului Berzelius. Este o reacție de descompunere, întrucât avem un singur reactant:
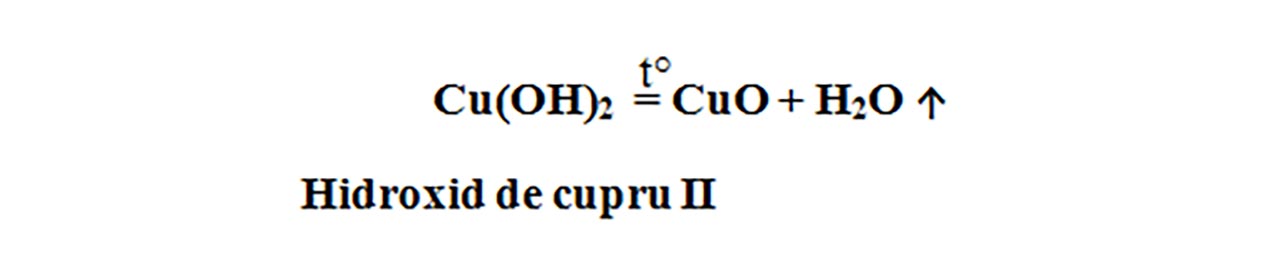
Experiment
4. Cum crește aluatul pentru prăjituri pufoase ?
Materiale necesare: eprubetă, bicarbonat de amoniu (amoniu alimentar) sau praf de copt (bicarbonat de sodiu), spirtieră, chibrit, spatulă, clește de lemn!
Atenție
Atenție când lucrezi cu surse de foc !
Descrierea experimentului:
- Pune în eprubetă un vârf de spatulă de bicarbonat de amoniu.
- Ține eprubeta cu cleștele de lemn și încălzește-o la flacăra spirtierei.
- Introdu în eprubetă un chibrit aprins. Ce observi ?
- Adu cu mâna spre nas gazul rezultat. Ce observi ?
- Privește cu atenție pereții eprubetei în partea de sus. Ce observi ?
Observaţie
Prin încălzire, bicarbonatul de amoniu se descompune cu degajare de dioxid de carbon (stinge flacăra bățului), amoniac (cu miros înțepător) și vapori de apă (care condensează pe pereții eprubetei).
Concluzia experimentului:
Bicarbonatul de amoniu, prin încălzire, se descompune și formează trei produși gazoși: dioxid de carbon (CO2), amoniac (NH3) și apă sub formă de vapori. Acești trei produși gazoși formează goluri în aluat și astfel prăjiturile ies foarte pufoase.
Este o reacție de descompunere, întrucât avem un singur reactant:
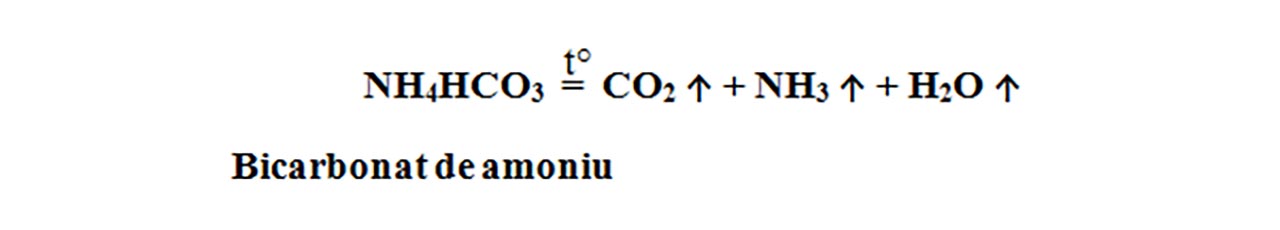
Experiment
5. Descompunerea cloratului de potasiu
Materiale necesare: eprubetă, clorat de potasiu, dioxid de mangan (catalizator) spirtieră, chibrit, spatulă, clește de lemn, așchii de brad.
Atenție
Experiment demonstrativ efectuat numai de către profesor!
Cloratul de potasiu este exploziv ! Atenție când lucrezi cu surse de foc !
Descrierea experimentului:
- Pune în epubetă un vârf de spatulă de clorat de potasiu (cristale albe) și puțin praf negru de dioxid de mangan.
- Ține eprubeta cu cleștele de lemn și încălzește-o la flacăra spirtierei.
- Vino cu o așchie de brad, care are câteva puncte incandescente și arunc-o în eprubetă.
- Ce observi ?
Observaţie
Prin încălzire, cloratul de potasiu se descompune energic, cu degajare de oxigen, care aprinde așchia de brad cu puncte incandescente.
Concluzia experimentului:
Cloratul de potasiu, la cald și în prezența catalizatorului ( MnO2 ), se descompune și formează clorură de potasiu – KCl , de culoare albă și oxigen – O2. Dioxidul de mangan nu participă la reacție, el se regăsește neconsumat în produșii de reacție. Este o reacție de descompunere, întrucât avem un singur reactant.
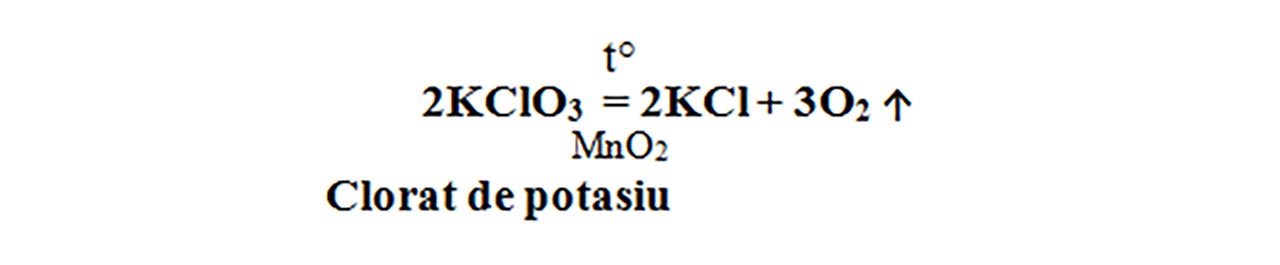
IV.3. Reacția de descompunere electrolitică.
Experiment
6. Descompunerea apei în hidrogen și oxigen
Materiale necesare: 2 eprubete, apă, electrolizor, chibrit, acid sulfuric diluat, baterie, mănuși chirurgicale, așchie de brad.
Atenție
Experiment demonstrativ efectuat numai de către profesor!
Acidul sulfuric este caustic !
Descrierea experimentului:
- Pune în electrolizor (vas de electroliză cu doi electrozi de grafit) apă și adaugă puțin acid sulfuric, pentru a o face conductoare (apa pură este izolatoare).
- Umple cele două eprubete tot cu apă acidulată, ca în electrolizor și pune-le pe fiecare electrod, astfel încât să nu se verse apa din ele.
- Leagă cei doi electrozi la o baterie și așteaptă până când în eprubete apa este înlocuită de două gaze.
- Vino cu o așchie de brad care are câteva puncte incandescente deasupra eprubetei de la anod (electrodul pozitiv, legat la borna plus a bateriei). Ce observi ?
- Vino cu un chibrit aprins deasupra eprubetei de la catod (electrodul negativ, legat la borna minus a bateriei). Ce observi ?
Observaţie
La anod s-a degajat oxigen, care aprinde așchia de brad cu puncte incandescente, iar la catod s-a degajat hidrogen, care arde în prezența oxigenului din aer cu o pocnitură.
Concluzia experimentului:

IV.4. Reacția de descompunere catalitică.
Experiment
7. Descompunerea apei oxigenate
Materiale necesare: eprubetă, apă oxigenată 12%, dioxid de mangan (catalizator), chibrit, spatulă, clește de lemn, așchii de brad.
Atenție
Experiment demonstrativ efectuat numai de către profesor!
Apa oxigenată concentrată este caustică!
Descrierea experimentului:
Pune în eprubetă apă oxigenată 12% și puțin praf negru de dioxid de mangan.
Ține eprubeta cu cleștele de lemn și vino deasupra ei cu o așchie de brad cu puncte incandescente.
- Ce observi ?
Observaţie
Apa oxigenată cu catalizator (MnO2) se descompune energic, cu degajare de oxigen, care aprinde așchia de brad cu puncte incandescente.
Concluzia experimentului:
Apa oxigenată în prezența catalizatorului ( MnO2 ), se descompune și formează apă – H2O și oxigen – O2. Iată de ce apa oxigenată are rol de dezinfectant și decolorant: oxigenul degajat la descompunerea ei, la lumină, distruge microbii și decolorează sângele de pe o rană sau în cosmetică, la decolorarea părului.
Este o reacție de descompunere, întrucât avem un singur reactant :
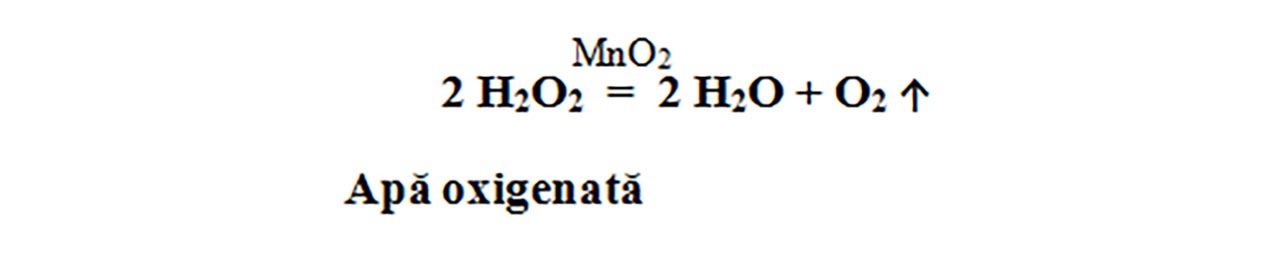
IV.5. Reacția de descompunere la lumină a halogenurilor de argint.
Experiment
8. Descompunerea halogenurilor
Materiale necesare: creuzet, bromură de argint.
warning
Atenție bromura de argint este toxică!
Descrierea experimentului:
- Pune în creuzet puțină bromură de argint (observă-i culoarea albă).
- Lasă la lumină bromura de argint.
- Ce observi ?
Observaţie
La lumină, bromura de argint, albă, s-a descompus într-un produs gri-închis.
Concluzia experimentului:
Halogenurile de argint sunt fotosensibile. Ele se descompun în prezența luminii în elemenele componente. Bromura de argint se decompune în argint – Ag (care se oxidează în aer și se înnegrește) și brom – Br2.
Este o reacție de descompunere, întrucât avem un singur reactant:

Reține!
Definiţie
Reacția de descompunere este reacția în care avem un singur reactant și mai mulți produși de reacție.
important

- Reactantul (A ) este întotdeauna o substanță compusă.
- Produșii reacției (B și C) pot fi atât substanțe simple, cât și substanțe compuse.
important
Ca tipuri de reacții de descompunere avem:
- Reacția de descompunere termică (prin încălzire) a unor carbonați, hidroxizi, oxizi, etc.
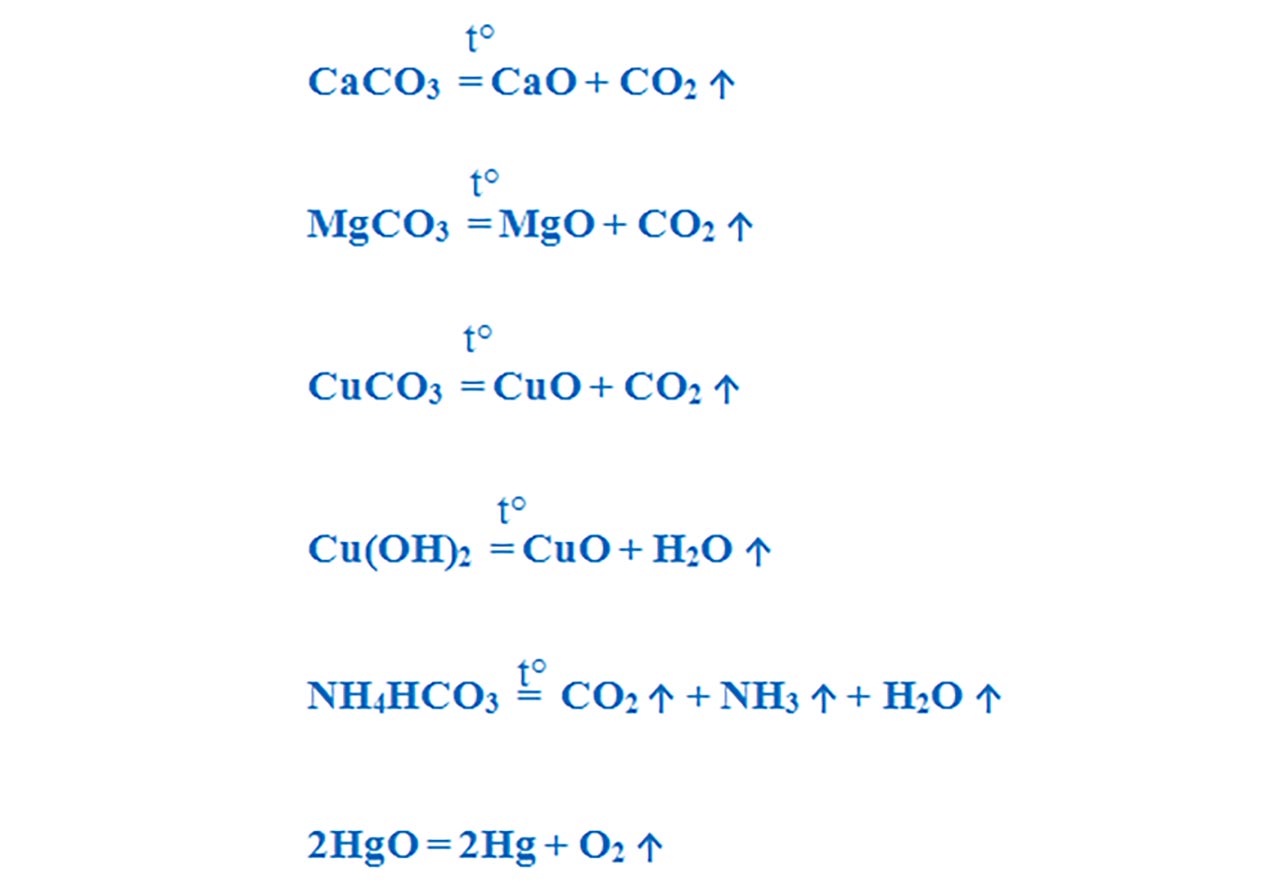
- Reacția de descompunere electrolitică (cu ajutorul curentului electric).

- Reacția de descompunere catalitică (cu ajutorul unui catalizator, care nu participă la reacție, doar mărește viteza reacției; el se regăsește în întregime în produșii de reacție).
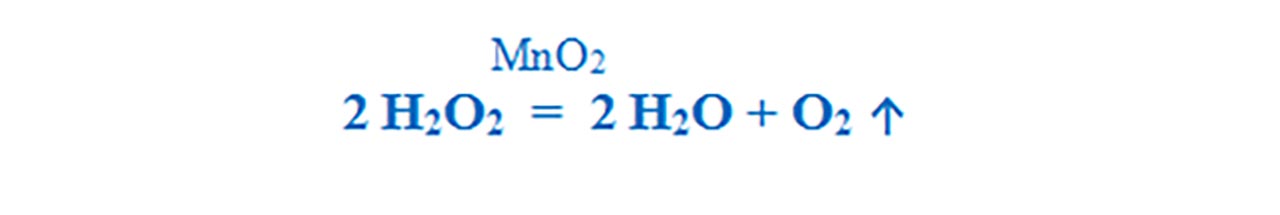
- Reacția de descompunere la lumină a halogenurilor de argint.
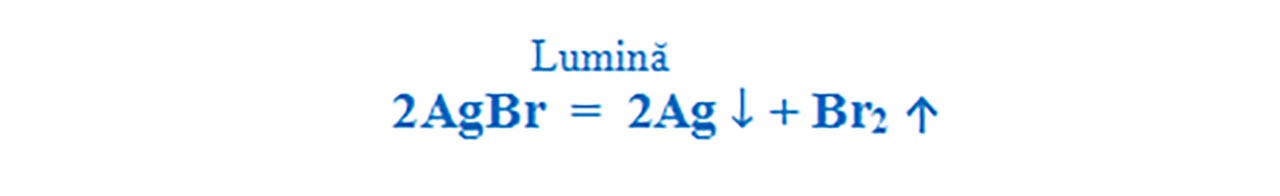
IV.6. Calcule stoechiometrice cu randament.
În curând