VI.TIPURI DE REACȚII CHIMICE. REACȚIA DE SCHIMB.
VI.1. Reacția de schimb (dublă înlocuire).
Știind că următoarele două reacții sunt reacții de schimb, descoperă caracteristica comună a celor două reacții:
CuS + HCl = CuCl2 + H2S ↑
2KOH + PbBr2 = 2KBr + Pb(OH)2 ↓
Observăm că avem un doi reactanți și doi produși de reacție, toți fiind substanțe compuse. Substanțele compuse au schimbat primul element între ele.
Definiţie
Reacția de schimb (dublă înlocuire) este reacția prin care două substanțe compuse își schimbă între ele două elemente chimice.
important
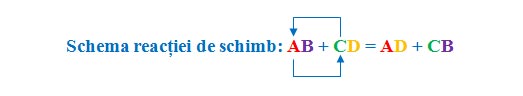
Ca reactanți avem două substanțe compuse (AB și CD), iar ca produși avem tot două substanțe compuse (AD și CB).
Primul element din substanța compusă ia locul primului element din a doua substanță compusă, iar primul element din a doua substanță compusă ia locul primului element din prima substanță compusă. Deci, primele elemente ale celor două substanțe compuse schimbă locul între ele și de aceea se mai numește și reacție de dublă înlocuire.
important
Ca tipuri de reacții de dublă înlocuire avem reacția dintre:
A) Un oxid metalic cu un acid
B) Un oxid nemetalic cu o bază
C) O bază cu un acid
D) O bază solubilă cu o sare
E) Un acid cu sare
F) O sare cu o sare.
Aplicaţii
Reacția de schimb este importantă, fiind folosită în industrie și în laborator pentru obținerea unor substanțe chimice cu multe utilizări și în laborator la recunoașterea unor substanțe, etc.
VI.2. Reacția dintre un oxid metalic cu un acid.
Experiment
1. Reacția dintre oxidul cupric și acidul clorhidric
Materiale necesare: eprubetă, acid clorhidric, oxid de cupru II, pipetă.
Atenție
Atenție, acidul clorhidric este caustic !
Descrierea experimentului:
Pune în eprubetă puțină pulbere neagră de oxid cupric și adaugă câteva picături de acid clorhidric.
Ce observi ?
Observaţie
Soluția obținută are culoare verde.
Concluzia experimentului:
Oxidul cupric – CuO reacționează cu acidul clorhidric - HCl și se transformă în clorură de cupru II - CuCl2 și apă. Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
CuO + 2HCl = CuCl2 + H2O
Experiment
2. Reacția dintre oxidul cupric și acidul sulfuric
Materiale necesare: eprubetă, acid sufuric, oxid de cupru II, pipetă, spirtieră, clește de lemn.
warning
Atenție, acidul sulfuric este caustic! Atenție când lucrezi cu surse de foc!
Descrierea experimentului:
Pune în eprubetă puțină pulbere neagră de oxid cupric și adaugă câteva picături de acid sulfuric. Încălzește eprubeta în flacăra spirtierei.
Ce observi ?
Observaţie
Soluția obținută are culoare albastră.
Concluzia experimentului:
Oxidul cupric – CuO reacționează cu acidul sulfuric - H2SO4 și se transformă în sulfat de cupru II - CuSO4 și apă. Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
CuO + H2SO4 = CuSO4 + H2O
VI.3. Reacția dintre un oxid nemetalic cu o bază.
Experiment
3. Reacția dintre dioxidul de carbon și hidroxidul de calciu (tulburarea apei de var)
Materiale necesare: flacon cu dop prevăzut cu un tub flexibil, oțet (soluție de acid acetic), bicarbonat de sodiu, pahar Berzelius, apă de var (hidroxid de calciu).
Descrierea experimentului:
- În paharul Berzelius pune soluție limpede de apă de var.
- Pune în flacon bicarbonat de sodiu și adaugă peste el oțet.
- Acoperă repede cu dopul, curbează tubul astfel încât dioxidul de carbon rezultat să fie barbotat (introdus) în soluția de apă de var.
- Ce observi ?
Observaţie
După puțin timp, soluția limpede începe să se tulbure, devenind albă și opacă.
Concluzia experimentului:
Dioxidul de carbon –, reacționează cu hidroxidul de calciu – Ca(OH)2, cu formarea carbonatului de calciu – CaCO3 și a apei – H2O. Reacția poartă numele de Tulburarea apei de var. Această reacție are o importanță practică la văruirea pereților. Oamenii dau cu lapte de var pe pereți, care reacționează cu dioxidul de carbon din aer și formează o crustă albă de carbonat de calciu, ce protejează pereții.
CO2 + Ca(OH)2 = CaCO3 + H2O
VI.4. Reacția dintre o bază și un acid (reacție de neutralizare).
Experiment
4. Reacția de neutralizare dintre hidroxidul de sodiu și acidul sulfuric
Materiale necesare: pahar Berzelius, soluție de hidroxid de sodiu (sodă caustică), acid sulfuric, termometru, pipetă.
warning
Atenție, hidroxidul de sodiu și acidul sulfuric sunt caustice și vă pot produce arsuri în contact cu pielea !
Descrierea experimentului:
- Pune în paharul Berzelius puțină soluție de sodă caustică și adaugă câteva picături de fenolftaleină.
- Așează în pahar un termometru și măsoară temperatura inițială a reacției.
- Adaugă cu pipeta acidul sulfuric, picătură cu picătură, până când colorația roșie dispare.
- Măsoară temperatura după terminarea reacției.
- Ce observi ?
Observaţie
Temperatura a crescut considerabil după dispariția culorii.
Concluzia experimentului:
Hidroxidul de sodiu – NaOH, reacționează cu acidul sulfuric - H2SO4 și se transformă în sulfat de sodiu - Na2SO4 și apă.
Reacția dintre o bază și un acid, cu formarea unei sări și apă, se numește reacție de neutralizare, fiind o reacție exotermă (care degajă căldură).
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
2NaOH + H2SO4 = Na2SO4 + 2H2O
VI.5. Reacția dintre o bază solubilă cu o sare solubilă
Experiment
5. Reacția dintre clorura de fier III și hidroxidul de sodiu
Materiale necesare: eprubetă, soluție de hidroxid de sodiu (sodă caustică), soluție de clorură de fier III, pipetă.
warning
Atenție, hidroxidul de sodiu este caustic și îți poate produce arsuri în contact cu pielea!
Descrierea experimentului:
Pune în eprubetă puțină soluție de clorură de fier III și adaugă câteva picături de hidroxid de sodiu.
Ce observi ?
Observaţie
S-a format un precipitat brun.
Concluzia experimentului:
Clorura de fier III – FeCl3, reacționează cu hidroxidul de sodiu - NaOH și se transformă în clorură de sodiu – NaCl și hidroxid de fier III - Fe(OH)3 (precipitat brun).
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3 ↓
Experiment
6. Reacția dintre acetatul de plumb și hidroxidul de sodiu
Materiale necesare: eprubetă, soluție de hidroxid de sodiu (sodă caustică), soluție de acetat de plumb II, pipetă.
Atenție
Atenție, hidroxidul de sodiu este caustic și îți poate produce arsuri în contact cu pielea!
Descrierea experimentului:
Pune în eprubetă puțină soluție de acetat de plumb II și adaugă câteva picături de hidroxid de sodiu.
Ce observi ?
Observaţie
S-a format un precipitat alb.
Concluzia experimentului:
Acetatul de plumb – Pb(CH3COO)2, reacționează cu hidroxidul de sodiu - NaOH și se transformă în acetat de sodiu – NaCH3COO și hidroxid de plumb II - Pb(OH)2 (precipitat alb).
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
Pb(CH3COO)2 + 2NaOH = 2NaCH3COO + Pb(OH)2 ↓
Experiment
7. Reacția dintre sulfatul de fier II și hidroxidul de sodiu
Materiale necesare: creuzet, soluție de hidroxid de sodiu (sodă caustică), soluție de sulfat de fier II, pipetă.
Atenție
Atenție, hidroxidul de sodiu este caustic și îți poate produce arsuri în contact cu pielea!
Descrierea experimentului:
Pune în creuzet puțină soluție de sulfat de fier II și adaugă câteva picături de hidroxid de sodiu.
Ce observi ?
Observaţie
S-a format un precipitat verde-gri.
Concluzia experimentului:
Sulfatul de fier II – FeSO4, reacționează cu hidroxidul de sodiu - NaOH și se transformă în sulfat de sodiu – Na2SO4 și hidroxid de fier II - Fe(OH)2 (precipitat verde).
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2 ↓
Experiment
8. Reacția dintre sulfatul de zinc și hidroxidul de sodiu
Materiale necesare: eprubetă, soluție de hidroxid de sodiu (sodă caustică), soluție de sulfat de zinc, pipetă.
Atenție
Atenție, hidroxidul de sodiu este caustic și îți poate produce arsuri în contact cu pielea!
Descrierea experimentului:
Pune în eprubetă puțină soluție de sulfat de zinc și adaugă câteva picături de hidroxid de sodiu.
Ce observi ?
Observaţie
S-a format un precipitat alb.
Concluzia experimentului:
Sulfatul de zinc – ZnSO4, reacționează cu hidroxidul de sodiu - NaOH și se transformă în sulfat de sodiu – Na2SO4 și hidroxid de zinc - Zn(OH)2 (precipitat alb).
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
ZnSO4 + 2NaOH = Na2SO4 + Zn(OH)2 ↓
Experiment
9. Reacția dintre sulfatul de cupru II și hidroxidul de sodiu
Materiale necesare: creuzet, soluție de hidroxid de sodiu (sodă caustică), soluție de sulfat de cupru II (piatră vânătă), pipetă.
Atenție
Atenție, hidroxidul de sodiu este caustic și îți poate produce arsuri în contact cu pielea!
Descrierea experimentului:
Pune în creuzet puțină soluție de sulfat de cupru II și adaugă câteva picături de hidroxid de sodiu.
Ce observi ?
Observaţie
S-a format un precipitat albastru intens.
Concluzia experimentului:
Sulfatul de cupru II – CuSO4, reacționează cu hidroxidul de sodiu - NaOH și se transformă în sulfat de sodiu – Na2SO4 și hidroxid de cupru II - Cu(OH)2 (precipitat albastru).
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2 ↓
Experiment
10. Reacția dintre azotatul de argint și hidroxidul de sodiu
Materiale necesare: eprubetă, soluție de hidroxid de sodiu (sodă caustică), soluție de azotat de argint (piatră iadului), pipetă.
warning
Atenție, hidroxidul de sodiu și azotatul de argint sunt caustice și îți pot produce arsuri în contact cu pielea !
Descrierea experimentului:
Pune în eprubetă puțină soluție de azotat de argint și adaugă câteva picături de hidroxid de sodiu.
Ce observi ?
Observaţie
S-a format un precipitat gri.
Concluzia experimentului:
Azotatul de argint – AgNO3, reacționează cu hidroxidul de sodiu - NaOH și se transformă în azotat de sodiu – NaNO3 și hidroxid de argint - AgOH (precipitat gri).
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
AgNO3 + NaOH = NaNO3 + AgOH ↓
VI.6. Reacția dintre un acid cu o sare.
Experiment
11. Reacția dintre sulfatul cupric și acidul clorhidric
Materiale necesare: eprubetă, soluție de sulfat de cupru (piatră vânătă), acid clorhidric, pipetă.
Atenție
Atenție, acidul clorhidric este caustic și îți poate produce arsuri în contact cu pielea !
Descrierea experimentului:
Pune în eprubetă puțină soluție de sulfat de cupru și adaugă câteva picături de acid clorhidric.
Ce observi ?
Observaţie
Soluția albastră s-a colorat în verde.
Concluzia experimentului:
Sulfatul de cupru II – CuSO4, reacționează cu acidul clorhidric - HCl și se transformă în clorură de cupru II - CuCl2 și acid sulfuric.
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
CuSO4 + 2HCl = CuCl2 + H2SO4
Experiment
12. Reacția dintre clorura de bariu și acidul sulfuric (reacție de recunoaștere)
Materiale necesare: creuzet, soluție de clorură de bariu, acid sulfuric, pipetă.
Atenție
Atenție, acidul sulfuric este caustic și îți poate produce arsuri în contact cu pielea ! Atenție, clorura de bariu este toxică !
Descrierea experimentului:
Pune în creuzet puțină soluție de acid sulfuric și adaugă câteva picături de clorură de bariu.
Ce observi ?
Observaţie
S-a format un precipitat alb.
Concluzia experimentului:
Clorura de bariu – BaCl2, reacționează cu acidul sulfuric - H2SO4 și se transformă în acid clorhidric – HCl și sulfat de bariu - BaSO4 (precipitat alb). Această reacție este folosită în laborator pentru recunoașterea acidului sulfuric și a sărurilor lui, sulfați.
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
BaCl2 + H2SO4 = 2HCl + BaSO4 ↓
Experiment
13. Reacția carbonatului de sodiu cu acidul clorhidric (reacție de recunoaștere)
Materiale necesare: eprubetă, carbonat de sodiu, soluție de acid clorhidric, pipetă, chibrit.
warning
Atenție, acidul clorhidric este caustic și îți poate produce arsuri în contact cu pielea !
Descrierea experimentului:
- Pune în eprubetă puțin carbonat de sodiu (praf de copt) și adaugă câteva picături de acid clorhidric (poți adăuga și oțet, care este un acid organic).
- Vino deasupra eprubetei cu un băț de chibrit aprins.
- Ce observi ?
Observaţie
Reacția este efervescentă și gazul rezultat stinge bățul de chibrit.
Concluzia experimentului:
Carbonatul de sodiu – Na2CO3, reacționează cu acidul clorhidric - HCl și se transformă în clorură de sodiu – NaCl și acid carbonic - H2CO3, care este instabil și se descompune în apă și dioxid de carbon –CO2 , care stinge flacăra chibritului. Reacția dintre un carbonat și un acid este folosită în laborator pentru recunoașterea carbonaților.
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
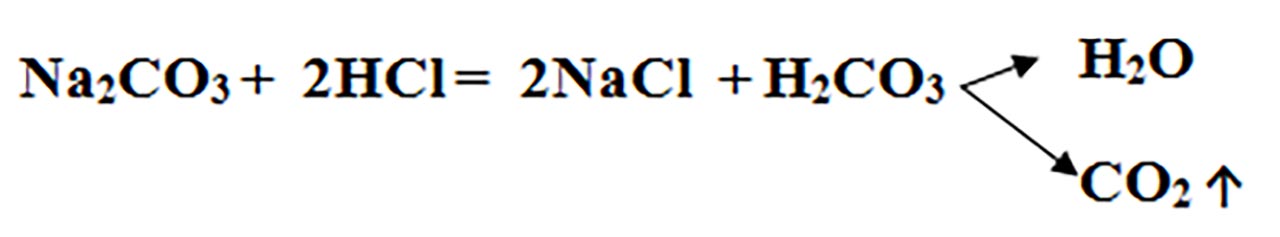
Experiment
14. Reacția carbonatului de calciu cu acidul acetic
Materiale necesare: pahar, oțet (soluție de acid acetic), un ou crud.
Descrierea experimentului:
Pune în pahar un ou crud și adaugă peste el oțet, cât să îl acopere. Reacția este extrem de lentă. Ține sub observație oul până când, oul rămâne fără coajă.
Ce observi ?
Observaţie
Imediat când punem oul în oțet, încep să iasă niște bule din coaja acestuia. După o zi, oul a rămas fără coajă și privit în lumină a devenit translucid.
Concluzia experimentului:
Carbonatul de calciu – CaCO3 (componentul principal al cojii de ou), reacționează cu acidul acetic din oțet- CH3COOH și se transformă în acetat de calciu – Ca(CH3COO)2 și acid carbonic - H2CO3, care este instabil și se descompune în apă și dioxid de carbon – CO2.
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
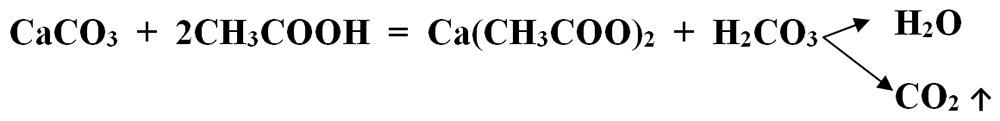
Observaţie Importantă
Există reacții chimice care nu au loc după niciunul dintre cele patru tipuri de reacții chimice studiate. Aceastea trebuie memorate.
Un astfel de exemplu, ai întâlnit la obținerea clorului din clorat de potasiu și acid clorhidric, la Experimentul nr.17:
KClO3 + 6HCl = KCl + 3H2O + 3Cl2 ↑
Avem ca reactanți două substanțe compuse, ca la reacția de schimb, însă reactanții nu schimbă câte un element între ei. În plus, ca produși avem trei substanțe, dintre care două compuse și una simplă.
În următoarele trei experimente vom mai observa astfel de reacții chimice.
VI.7. Reacția dintre o sare cu o sare.
Experiment
15. Reacția dintre clorura de sodiu și azotatul de argint (reacție de recunoaștere)
Materiale necesare: eprubetă, soluție de azotat de argint, soluție de clorură de sodiu, pipetă.
Atenție
Atenție, azotatul de argint este caustic și îți poate produce arsuri în contact cu pielea !
Descrierea experimentului:
Pune în eprubetă puțină soluție de clorură de sodiu și adaugă câteva picături de azotat de argint.
Ce observi ?
Observaţie
S-a format un precipitat alb.
Concluzia experimentului:
Clorura de sodiu – NaCl, reacționează cu azotatul de argint - AgNO3 și se transformă în azotat de sodiu – NaNO3 și clorură de argint - AgCl (precipitat alb). Această reacție este folosită în laborator pentru recunoașterea acidului clorhidric și a sărurilor lui, cloruri.
Este o reacție de schimb, deoarece avem ca reactanți două substanțe compuse, iar ca produși avem tot două substanțe compuse:
NaCl + AgNO3 = NaNO3 + AgCl ↓
Reține!
Definiţie
Reacția de schimb (dublă înlocuire) este reacția prin care două substanțe compuse își schimbă între ele două elemente chimice.
important
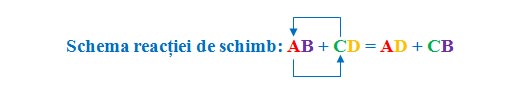
Ca reactanți avem două substanțe compuse (AB și CD), iar ca produși avem tot două substanțe compuse (AD și CB).
Primul element din substanța compusă ia locul primului element din a doua substanță compusă, iar primul element din a doua substanță compusă ia locul primului element din prima substanță compusă. Deci, primele elemente ale celor două substanțe compuse schimbă locul între ele și de aceea se mai numește și reacție de dublă înlocuire.
important
Ca tipuri de reacții de dublă înlocuire avem reacția dintre:
1) oxid metalic + acid = sare + apă
CuO + 2HCl = CuCl2 + H2O
CuO + H2SO4 = CuSO4 + H2O
2) oxid nemetalic + bază = sare + apă
- CO2 + Ca(OH)2 = CaCO3 + H2O
3) bază + acid = sare + apă
- 2NaOH + H2SO4 = Na2SO4 + 2H2O
4) sare solubilă + bază solubilă = sare + bază insolubilă (precipitat)
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3 ↓
Pb(CH3COO)2 + 2NaOH = 2NaCH3COO + Pb(OH)2 ↓
FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2 ↓
ZnSO4 + 2NaOH = Na2SO4 + Zn(OH)2 ↓
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2 ↓
AgNO3 + NaOH = NaNO3 + AgOH ↓
5) sare + acid = sare + acid mai slab
CuSO4 +2 HCl = CuCl2 + H2SO4
BaCl2 + H2SO4 = BaSO4 ↓ + 2HCl
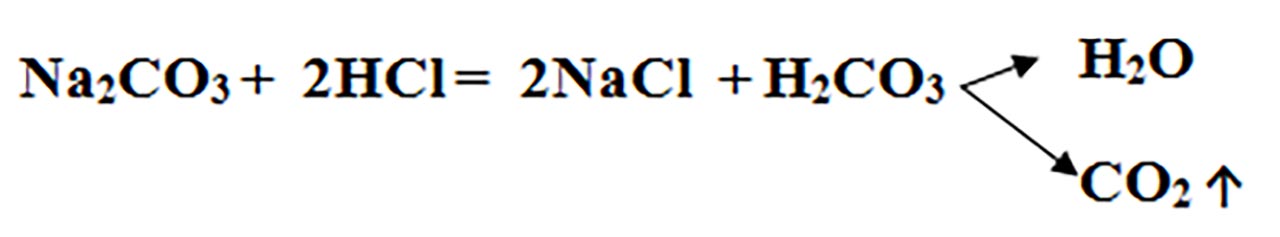
6) sare solubilă + sare solubilă = sare + sare
- NaCl + AgNO3 = NaNO3 + AgCl ↓
VI.8. Reacții atipice. Reacția cuprului cu oxiacizi (acid azotic, acid sulfuric).
Există reacții chimice care nu au loc după niciunul dintre cele patru tipuri de reacții chimice studiate. Aceastea trebuie memorate.
Un astfel de exemplu, ai întâlnit la obținerea clorului din clorat de potasiu și acid clorhidric .
KClO3 + 6HCl = KCl + 3H2O+3 Cl2 ↑
Avem ca reactanți două substanțe compuse, ca la reacția de schimb, însă reactanții nu schimbă câte un element între ei. În plus, ca produși avem trei substanțe, dintre care două compuse și una simplă.
În următoarele două experimente vom observa astfel de reacții chimice.
Experiment
16. Reacția cuprului cu acidul azotic
Materiale necesare: eprubetă, acid azotic concentrat, granule de cupru, pipetă.
Atenție
Experiment demonstrativ efectuat numai de profesor sub nișă!
Atenție, acidul azotic este extrem de caustic ! Atenție, gazul rezultat, dioxidul de azot este extrem de toxic și coroziv!
Descrierea experimentului:
În eprubetă pune câteva granule de cupru.
Pune cu pipeta câteva picături de acid azotic concentrat peste cupru.
Ce observi ?
Observaţie
După puțin timp, se degajă un gaz roșu-brun.
Concluzia experimentului:
Cuprul – Cu, reacționează la rece cu acidul azotic – HNO3, cu formarea azotatului de cupru II – Cu(NO3)2, apei – H2O și monoxid de azot – NO (gaz incolor). Ca reacție secundară avem oxidarea monoxidului de azot în oxigenul din aer, cu formarea dioxidului de azot – NO2 , numit și hipoazotită (gaz roșu-brun).
3Cu + 8HNO3 = 3Cu(NO3)2 + 4H2O + 2NO↑ (Această reacție este foarte greu de egalat. Eu rețin coeficienții reactanților și apoi o egalez).
2NO + O2 = 2NO2 ↑
Observaţie
Observă faptul că, cuprul nu scoate hidrogenul din acizi, deoarece se află după hidrogen în seria activității chimice a metalelor.
Experiment
17. Reacția cuprului cu acidul sulfuric
Materiale necesare: eprubetă, acid sulfuric concentrat, granule de cupru, pipetă, clește de lemn, spirtieră.
warning
Experiment demonstrativ efectuat numai de profesor sub nișă!
Atenție, acidul sulfuric este extrem de caustic ! Atenție, gazul rezultat, dioxidul de sulf este extrem de toxic și coroziv ! Atenție când lucrezi cu surse de foc!
Descrierea experimentului:
- În eprubetă pune câteva granule de cupru.
- Pune cu pipeta câteva picături de acid sulfuric concentrat peste cupru.
- Încălzește eprubeta cu cleștele de lemn, în flacăra spirtierei.
- Ce observi ?
Observaţie
După puțin timp, se degajă un gaz albicios.
Concluzia experimentului:
Cuprul – Cu, reacționează la cald cu acidul sulfuric, – H2SO4, cu formarea sulfatului de cupru II – CuSO4, apei – H2O și dioxidului de sulf – SO2 (gaz incolor-albicios).
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 ↑
Observaţie
Observă faptul că, cuprul nu scoate hidrogenul din acizi, deoarece se află după hidrogen în seria activității chimice a metalelor.
VI.9. Aplică ce ai învăţat în legătură cu Tipurile de reacţii chimice
Temă
1. Scrie ecuațiile chimice și tipul fiecărei reacții chimice :
a) Al + Fe2O3 => Fe + Al2O3
b) Na2O + H3PO4 => Na3PO4 + H2O
c) Fe + F2 => FeF3
d) H2CO3 => H2O + CO2 ↑
e) NH3 + H2O => NH4OH
f) MgCO3 => MgO + CO2 ↑
g) Zn(OH)2 + HNO3 => Zn(NO3)2 + H2O
h) NiO + C => Ni + CO2 ↑
Temă
2. Scrie substanțele lipsă în locurile punctate, apoi ecuațiile chimice și tipul fiecărei reacții chimice:
a) KOH + Al2(CO3)3 => ........ + Al(OH)3
b) Zn + HNO3 => Zn(NO3)2 + ........
c) Zn + ....... => ZnO
d) ........ => CaO + CO2 ↑