III. ATOMUL.
3.1. Structura atomului.
În Grecia antică, în urmă cu 2400 de ani, filozoful Democrit a folosit termenul de atom pentru a desemna cele mai mici părți dintr-un corp și care înseamnă, în limba greacă, indivizibil.
Definiţie
Atomul este cea mai mică particulă dintr-o substanță care nu mai poate fi divizată prin procedee chimice obișnuite.
important
- Nucleul este partea centrală a atomului, alcătuit din particule numite nucleoni, și anume:
Protoni, particule încărcate cu sarcină pozitivă, cu simbolul p+1.
Neutroni, particule neutre din punct de vedere electric, cu simbolul n0.
- Învelișul electronic este spațiul din jurul nucleului format dintr-un nor de particule numite electroni care gravitează în jurul nucleului. Electronii sunt particule cu sarcină negativă, cu simbolul e-1 sau ē.
Prin frecarea dintre două corpuri, acestea se electrizează și se încarcă cu sarcini electrice , pozitive sau negative.
Definiţie
Sarcina electrică = q, este o mărime fizică care măsoară starea de electrizare a unui corp și se măsoară în C(Coulomb).
Definiţie
Electronul este particula cu cea mai mică sarcină , considerată unitatea naturală de sarcină şi notată cu e. El are o sarcină negativă egală cu 1,6 ∙ 10-19 C, fiind egală cu sarcina protonului, de semn opus, fiind numită sarcină electrică elementară (qe).
Definiţie
Sarcina unui corp ( Q ) este un multiplu întreg al sarcinii electrice elementare:
Q = n ∙ qe, unde n = nr.întreg și qe = sarcină electrică elementară = 1,6 ∙ 10-19 C .
Caracteristici ale particulelor elementare (subatomice):
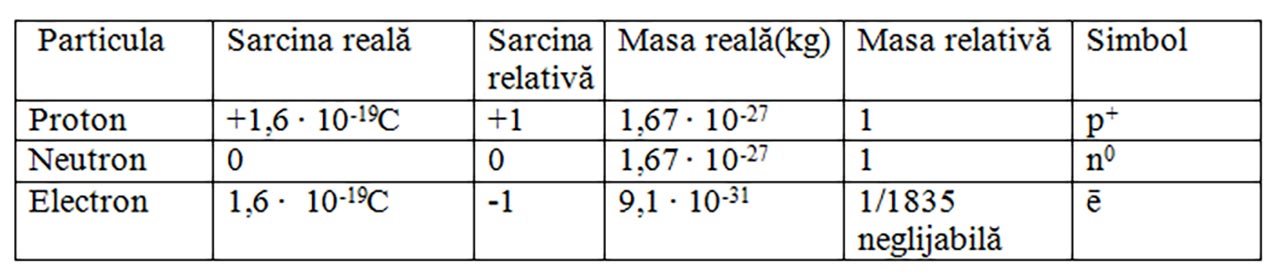
important
Atomul este o particulă neutră din punct de vedere electric, deoarece are numărul de protoni din nucleu ( particule pozitive) egal cu numărul de electroni din învelișul electronic (particule negative), adică
nr. p+ = nr. ē
Definiţie
Pentru un atom definim numărul atomic (numit și sarcina nucleară sau nr. de ordine), Z, care reprezintă numărul de protoni din nucleu, care este egal cu numărul de electroni din înveliș:
Z = nr. p+ = nr. ē
Definiţie
Pentru orice atom se defineşte numărul de masă, A, care reprezintă numărul total de protoni şi neutroni din nucleul atomic. El reprezintă numărul întreg, cel mai apropiat de masa atomică reală a speciei respective :
A = nr. p+ + nr. n0
Definiţie
Numărul de neutroni din nucleu, N, se numeşte număr neutronic :
N = A – Z
3.2. Element chimic
Definiţie
Elementul chimic reprezintă totalitatea atomilor care au același număr atomic Z.
În prezent se cunosc 118 elemente chimice. Fiecare are o denumire și o notație prescurtată.
Definiţie
Simbolul chimic este litera sau grupul de două litere cu care se notează în mod convențional un element chimic.
Observaţie
Întodeauna prima literă a simbolului este literă mare, iar a doua literă mică.
a) La unele elemente, simbolul este prima literă sau primele 2 litere din denumire :
Calciu = Ca
Clor = Cl
Carbon = C
Aur = Au
Fluor = F
b) La unele elemente simbolul este prima literă și o altă literă din simbol:
Staniu = Sn
Fier = Fe
Cesiu = Cs
c) La alte elemente simbolul nu seamănă cu denumirea din limba română, pentru aceste elemente simbolul provine din denumirea elementului în limba latină:
Hydrargir = Mercur = Hg
Natriu = Sodiu = Na
Kaliu = Potasiu = K
Nitrogen = Azot = N
Phosphor = Fosfor = P
important
Simbolul chimic are o dublă semnificație:
a) Calitativă - reprezintă un anumit element chimic
b) Cantitativă - la scară atomică, reprezintă un atom al elementului respectiv.
Exemple:
Mg:
a) elementul chimic magneziu
b) un atom de magneziu
3 Cl:
a) elementul chimic clor
b) trei atomi de clor
important
Un element chimic cu simbolul E se notează astfel:
Observaţie
Atenție! În sistemul periodic, în fiecare căsuță a elementului chimic, deasupra simbolului este trecut nr. atomic Z, iar sub simbol este trecut nr. de masă A, invers cum îl scriem noi pe caiet.
Oxigenul se găsește răspândit sub forma a 3 atomi:
Ce asemănări și deosebiri observi între acești atomi?
Cei 3 atomi au același nr.atomic Z (adică același nr de protoni), dar au nr. de masă diferit (adică nr. de neutroni diferit).
Definiţie
Izotopii sunt speciile de atomi cu același Z, dar cu A diferit.
Observaţie
Până în prezent se cunosc 118 elemente (90 găsite în natură şi 28 obţinute artificial). Unii atomi având numere atomice, Z, identice şi numere de masă, A, diferite se numesc izotopi. Izotopii deşi au mase atomice diferite au proprietăţi fizice şi chimice asemănătoare.
Exemplu:
- Hidrogenul are trei izotopi:
Observaţie
Deşi există în natură elemente compuse din atomi de un singur fel (monoizotopice) cum ar fi fluorul, sodiul, aluminiul, fosforul, majoritatea elementelor sunt însă amestecuri de izotopi, uneori de mulţi izotopi, cum ar fi staniul care prezintă10 izotopi. Asemenea elemente se numesc elemente mixte.
Izotopii anumitor elemente, mai ales ai elementelor cu nr. de masă mare, au nuclee instabile, fiind radioactive.
Temă
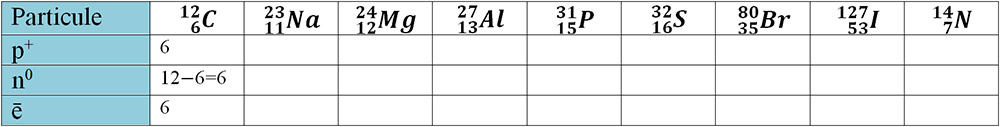
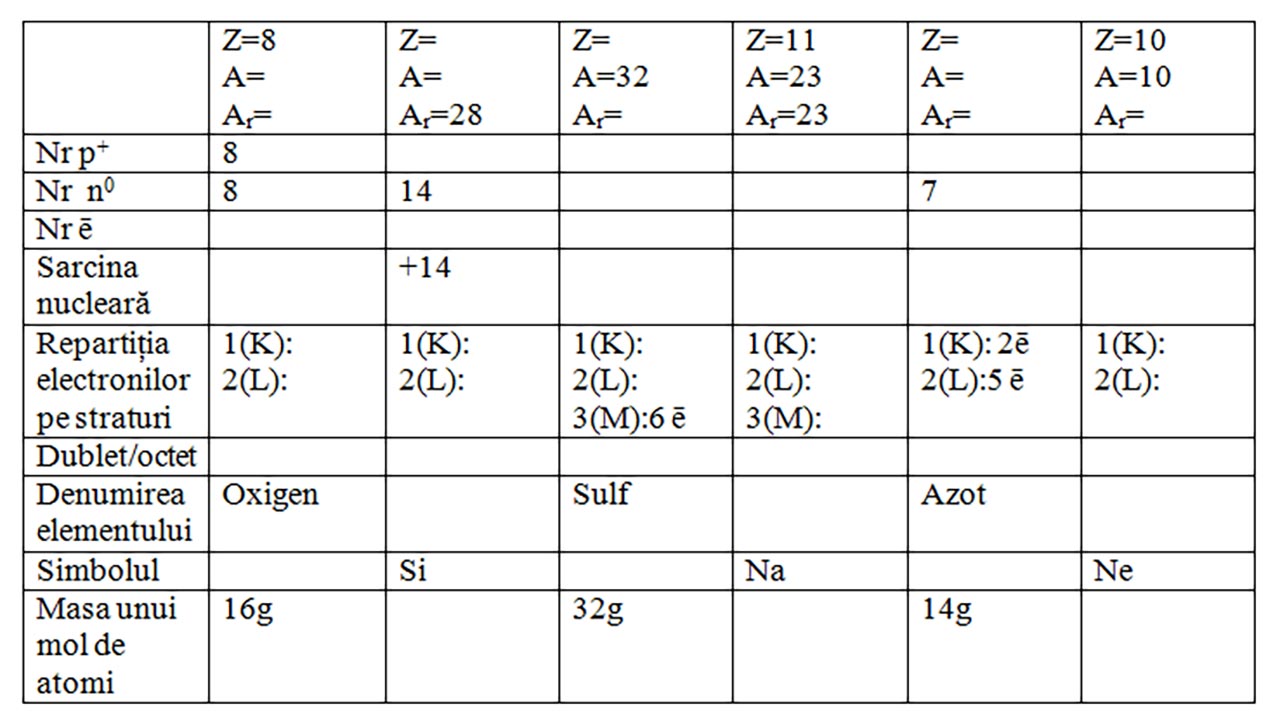
1. Completați pe caiet tabelul după modelul carbonului:
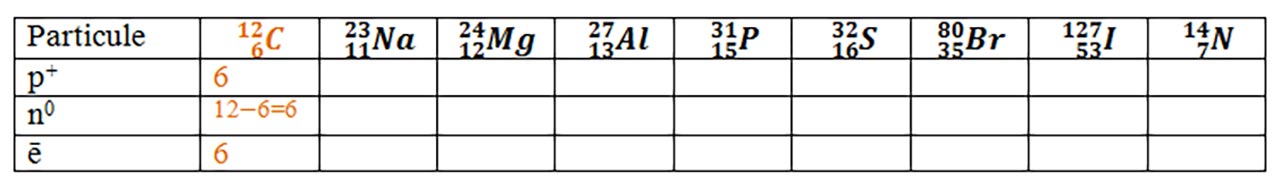
Observaţie
Nr. atomic, Z, este numărul scris deasupra simbolului elementului chimic în tabelul periodic, de pe a doua coperta a manualului.
Nr. de masă, A, este numărul scris sub simbolului elementului chimic în tabelul periodic, de pe a doua coperta a manualului, luat întreg prin aproximare.
Nr. neutronic, N, se calculează cu formula : N = A – Z
Temă
2. Utilizând noțiunile învățate , completează tabelul de mai jos, cu referire la compoziția diferiților atomi, după modelul magneziului.

3.3. Masa atomică. Mol de atomi.
Atomul de oxigen este alcătuit din 8 protoni, 8 neutroni și 8 electroni. Pentru a calcula masa acestuia însumăm masele particulelor componente.
mO = 8 ∙ ( 1,67 ∙ 10-27 + 1,67 ∙ 10-27 + 9,1∙ 10-31) ~ 26,72 ∙ 10-27 kg
Observăm că masele reale ale atomilor sunt foarte mici și dificil de utilizat în calculele chimice. În locul lor se utilizează masele atomice relative, adică masele atomice raportate la unitatea atomică de masă (u.a.m.).
Definiţie
Unitatea atomică de masă (u.a.m.) reprezintă a 12-a parte din masa izotopului de carbon,
Definiţie
Masa atomică relativă (A) este numărul care arată de câte ori masa unui atom este mai mare decât unitatea atomică de masă.
Observaţie
Masa atomică relativă medie este valoarea trecută în tabelul periodic în dreptul simbolului fiecărui element, şi este, de obicei, un număr raţional (a nu se confunda cu numărul de masă A care este un număr întreg).
În cazul unui element chimic care se găseşte în natură sub forma a mai mulţi izotopi stabili, masa atomică relativă medie este dependentă de:
- masa atomică relativă a fiecărui izotop;
- procentul sau abundenţa izotopului în compoziţia elementului în natură .
Exemplu – Calculul masei atomice în cazul elementului clor
1. Completați pe caiet tabelul după modelul carbonului:
Masa atomică relativă medie a elementului clor este ACl = 35,45.
Clorul se găseşte în natură sub forma a doi izotopi stabili: izotopul
are în nucleu 17 p+ şi 18 neutroni, iar în învelişul electronic are 17 ē, având o pondere de 75,4%
și izotopul
are în nucleu 17 p+ şi 20 neutroni, iar în învelişul electronic are 17 ē , având o pondere de 24,6%.
Astfel, masa atomică relativă medie a clorului va fi:
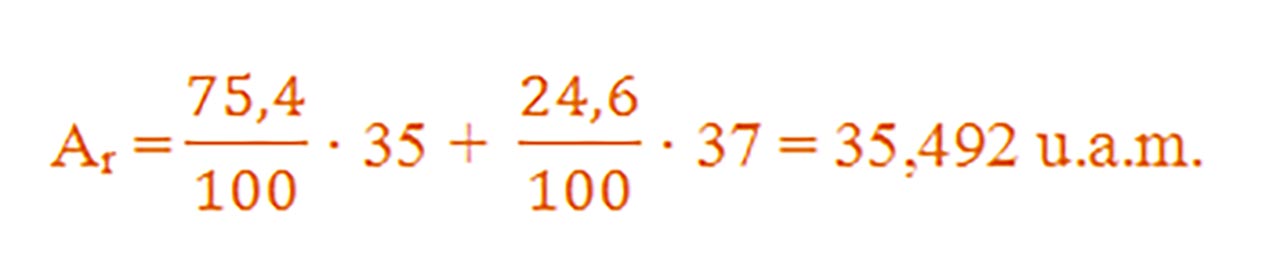
Definiţie
Un mol de atomi reprezintă cantitatea, în grame, dintr-o substanţă simplă care conţine 6,022 ∙ 1023 de atomi. Se mai numeşte şi atom gram. Se notează cu litera grecească ”niu”= υ.

Definiţie
Numărul lui Avogadro, notat cu NA, este egal cu 6,022 ∙1023 atomi şi reprezintă numărul de atomi conţinuţi într-un mol de atomi din orice element chimic.
Problemă model
1. Cât este masa ce conține 4 moli de atomi de neon ( A = 20 g/mol) ?
Rezolvare:
Putem afla masa ori cu regula de trei simplă, ori cu formula numărului de moli:
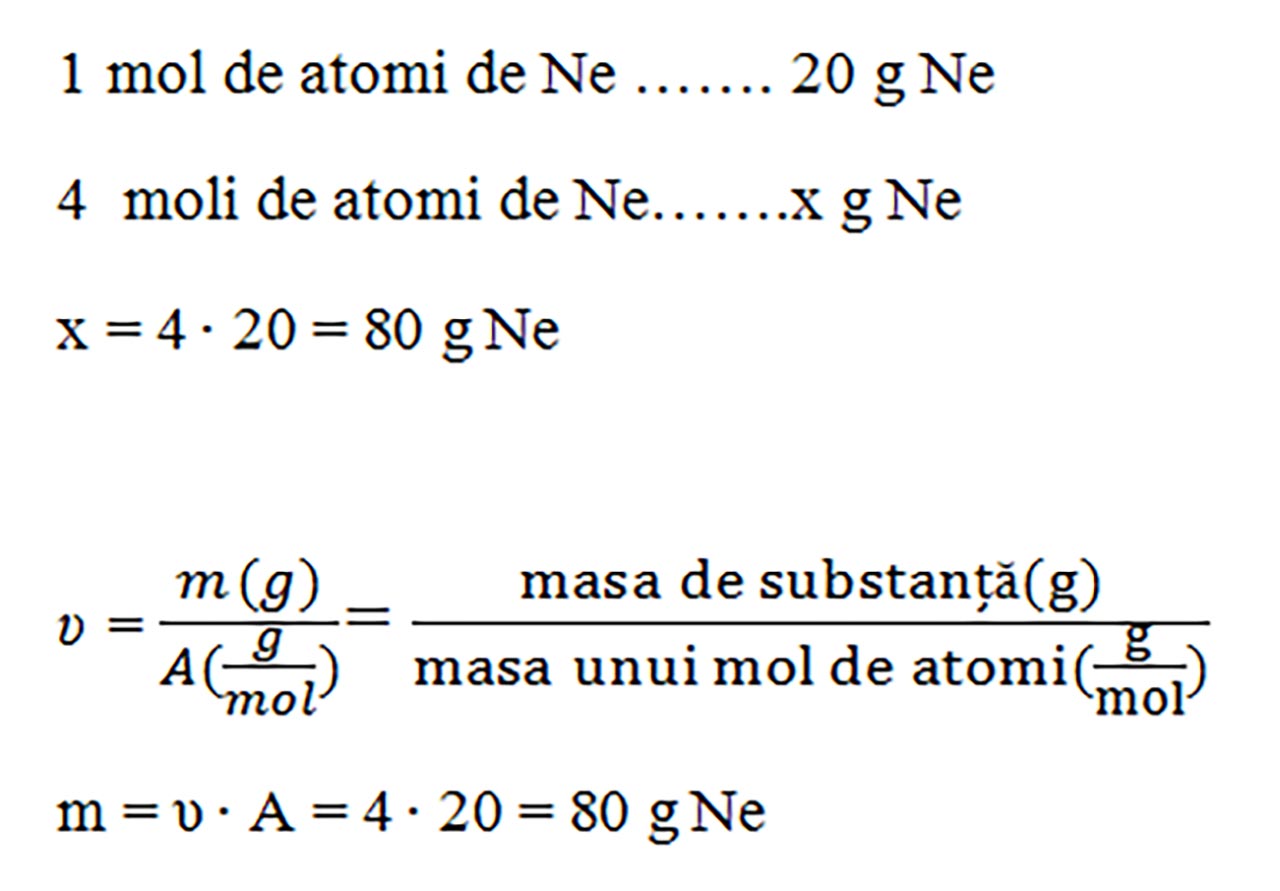
Problemă model
2. Câți moli de atomi sunt cuprinși în 11,2 g de Fe (AFe =56 g/mol ) ?
Rezolvare:
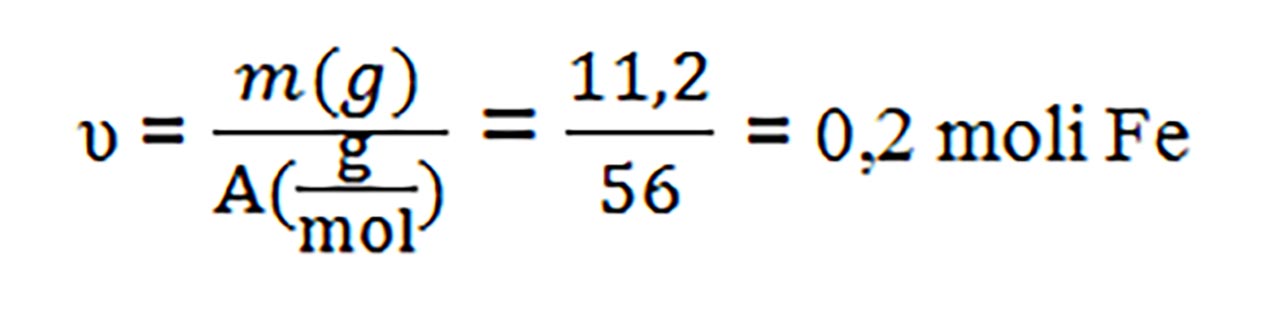
Problemă model
3. Ce masă au 2moli de Cu (ACu =64) ?
Rezolvare:
m = υ ∙ A= 2 ∙ 64 = 128 g Cu
Problemă model
4. Câți atomi se găsesc în 16g S(AS =32) ?
Rezolvare:
- Întâi aflăm nr. de moli cuprinși în 16g S :
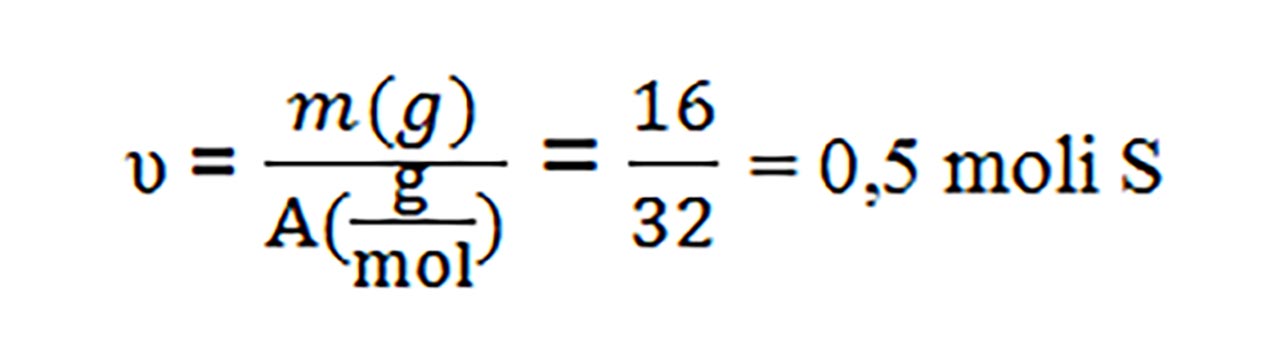
- Transformăm nr. de moli în nr de atomi, cu regula de trei simplă:
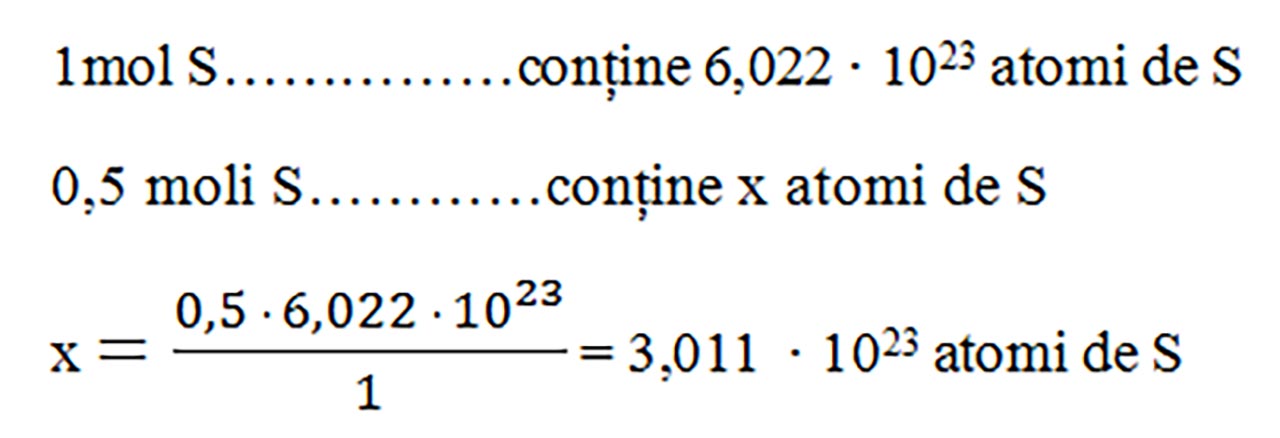
3.4. Învelișul de electroni.
Modelul “planetar” al atomului (modelul lui Ruther) folosește asemănarea dintre Soare și nucleul atomului și planetele care se rotesc în jurul Soarelui cu electronii din învelișul electronic.
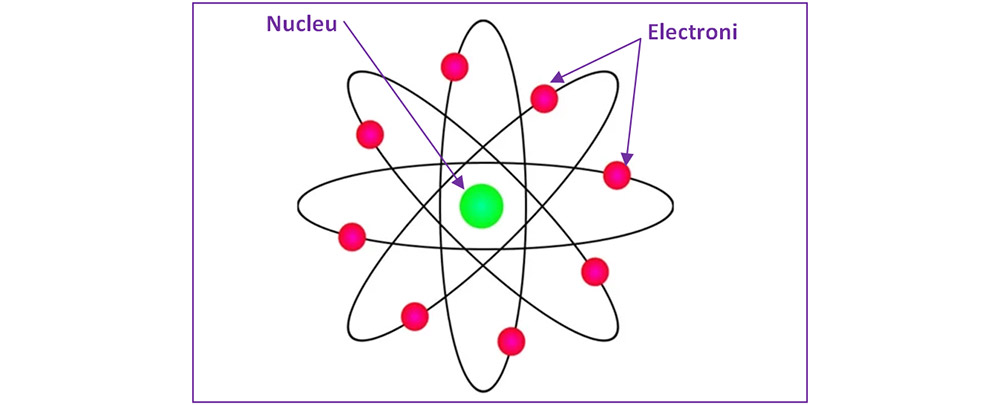
Definiţie
Învelișul electronic reprezintă totalitatea electronilor care orbitează în jurul nucleului atomic.
Observaţie
Electronii realizează două tipuri de rotații:
în jurul nucleului
în jurul propriilor axe.
important
Învelișul electronic are o structură stratificată, fiind format din șapte straturi (nivele) concentrice nucleului și numerotate de la nucleu către exterior cu 1, 2, 3, 4, 5, 6 şi 7 sau cu litere începând de la litera K (K, L, M, N, O, P și Q).
Observaţie
Într-un atom, electronii tind să ocupe pozițiile cele mai stabile , caracterizate de energia cea mai mică. Energia straturilor crește de la primul strat din jurul nucleului spre exterior. Aceasta este și ordinea de repartizare a electronilor pe straturi.
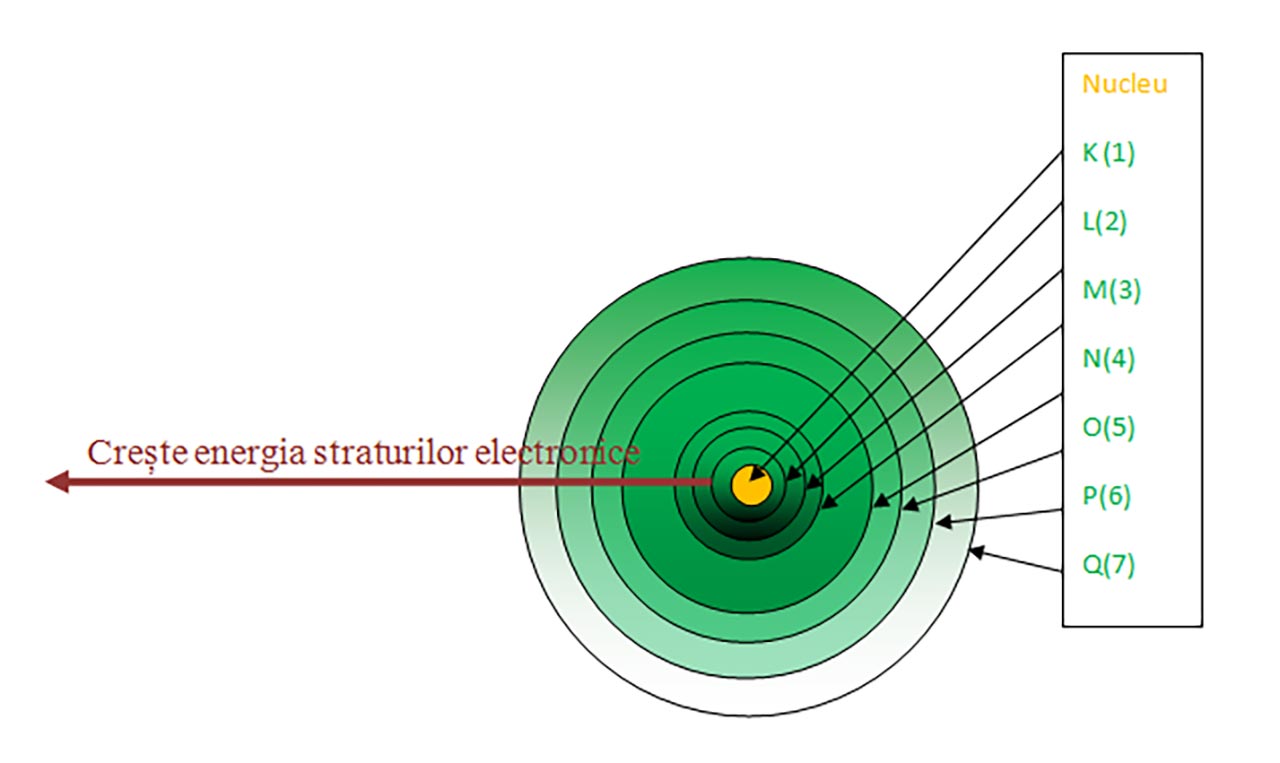
Observaţie
Toți electronii sunt identici pentru că au aceeași masă (9,1 ∙ 10-31 kg), aceleași dimensiuni, aceeași sarcina electrică ( q = - 1,6 ∙ 10-19 C ).
Forțele de atracție electrostatică dintre nucleul încărcat pozitiv și electronii încărcați negativ, explică mișcarea acestora în jurul nucleului.
Caracteristicile învelișului electronic:
volum mare, în comparație cu volumul nucleului.
masă mică, electronii având masă neglijabilă.
încărcat cu sarcini negative.
Definiţie
Repartiția pe straturi a celor Z electroni ai unui atom reprezintă structura electronică a atomului.
important
Ocuparea straturilor cu electroni respectă anumite reguli:
electronii ocupă straturile în ordine, începând de la cel mai apropiat de nucleu;
fiecare strat conține un număr limitat de electroni;
numărul maxim de electroni de pe un nivel energetic este dat de formula:
nr max ē = 2n2,
unde n = nr. stratului
Exemplu
a) pentru stratul K, n=1, nr max ē = 2n2 = 2 ∙ 12 = 2 electroni
b) pentru stratul L, n=2, nr max ē = 2n2 = 2 ∙ 22 = 8 electroni
c) pentru stratul M, n=3, nr max ē = 2n2 = 2 ∙ 32 = 18 electroni
Observaţie
Cel mai folosit model de structură a învelișului electronic este modelul Bohr, în care straturile sunt cercuri concentrice cu nucleul la mijloc.
Problemă Model
5. Reprezintă structura atomului de
Rezolvare:
În mijloc reprezentăm nucleul cu protoni ( Z = 17 = nr. p+) și neutroni ( N = A - Z = 35- 17 = 18 = nr. n0)
În jurul nucleului reprezentămŞ
- stratul 1 = K, cu maxim 2ē
- stratul 2 = L, cu max 8ē
- stratul 3 = L, cu 7ē.
În total trebuie să avem 17 ē, întrucât Z = 17 = nr. electroni din învelișul electronic.
Straturile neocupate cu electroni nu se mai desenează.
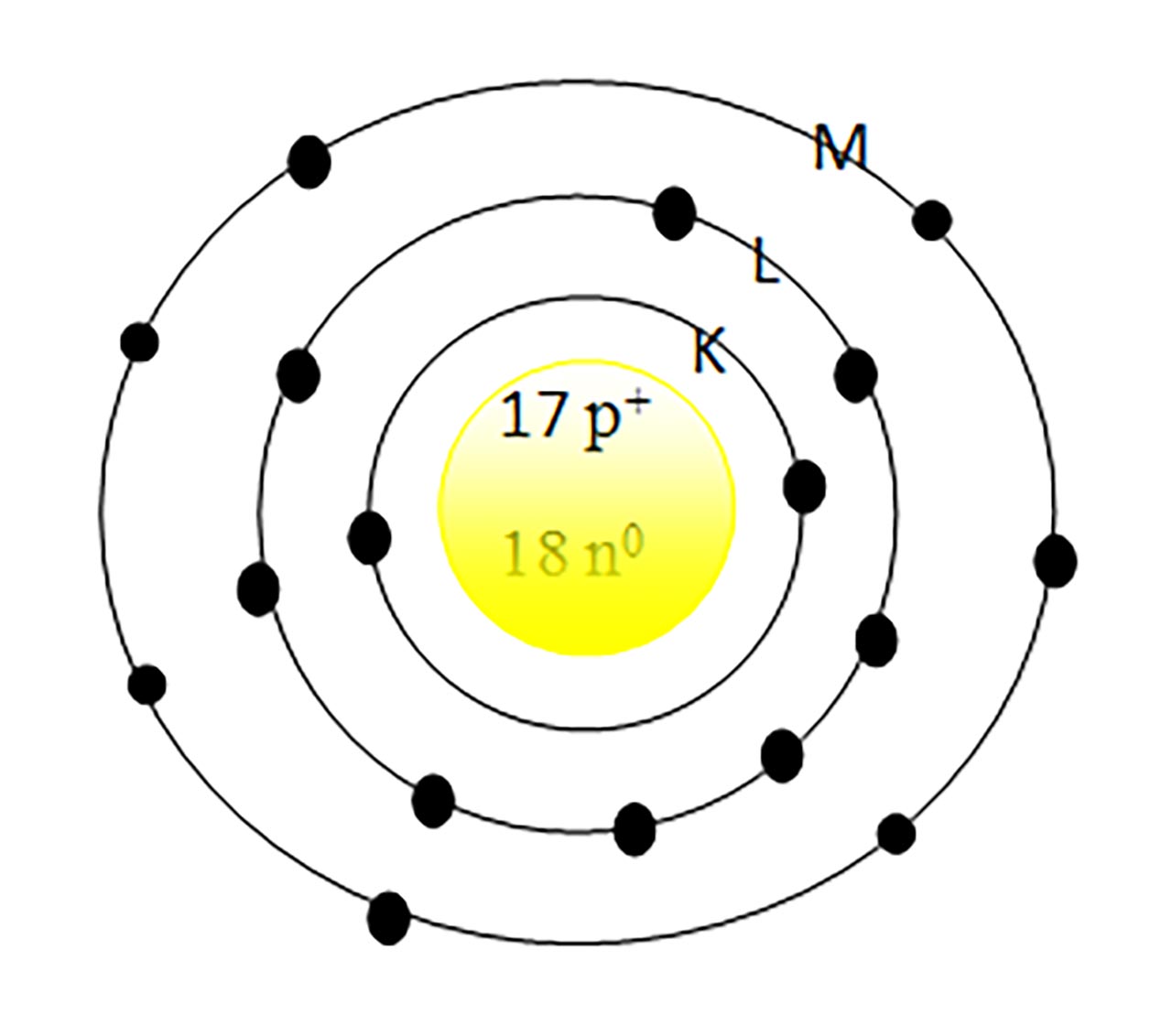
Problemă Model
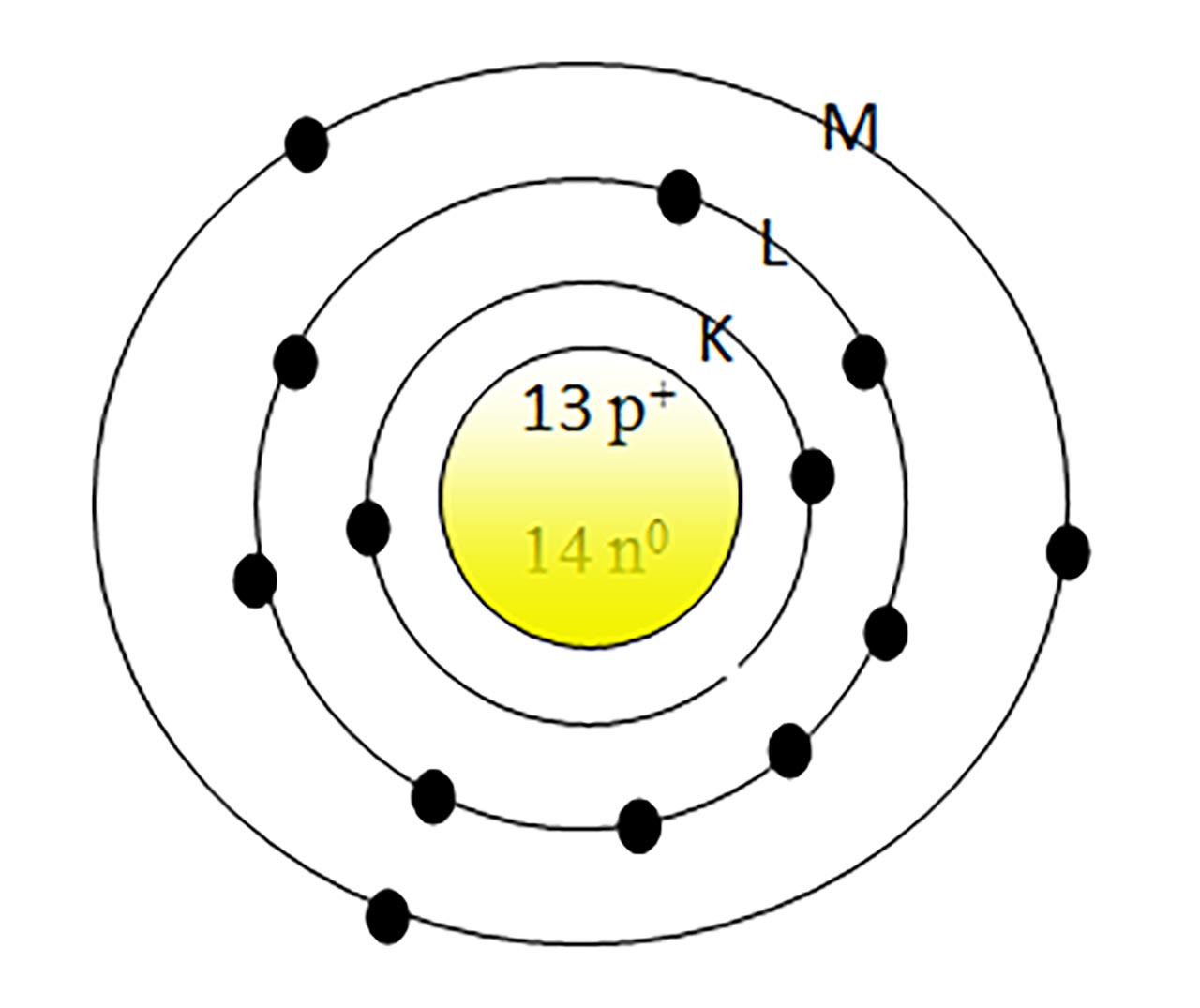
6. Reprezintă structura atomului de
Rezolvare:
În mijloc reprezentăm nucleul cu protoni ( Z = 13 = nr. p+) și neutroni ( N = A - Z = 27 - 13 = 14 = nr. n0)
În jurul nucleului reprezentăm:
- stratul 1 = K, cu maxim 2ē
- stratul 2 = L, cu max 8ē
- stratul 3 = L, cu 3ē.
În total trebuie să avem 13 ē, întrucât Z = 13 = nr. electroni din învelișul electronic.
Straturile neocupate cu electroni nu se mai desenează.
Definiţie
Doi electroni pe primul strat, K, este o configurație stabilă, numită dublet.
Definiţie
Opt electroni pe celelalte straturi, L-Q, este o configurație stabilă, numită octet.
Definiţie
Elementele a căror atomi au structuri stabile pe ultimul strat, de dublet sau octet, se numesc gaze rare.
Temă
I. Alege varianta corectă:
1) Nr. maxim de electroni de pe stratul L este :
a) 8;
b) 2;
c) 18;
d) 12.
2) Are configurație stabilă de dublet:
a) magneziu;
b) sulf;
c) heliu;
d) calciu.
3) Atomul căruia îi lipsesc 2 electroni pentru a avea configurația stabilă de octet pe stratul L:
a) Este fosfor;
b) Are Z = 8;
c) Are 6n0;
d) Are A = 31.
4) Un element chimic are Z = 5 și A = 11. Este adevărat că:
a) Are structură stabilă;
b) Are 16electroni;
c) Are 11protoni;
d) Are 3 ē pe ultimul strat.
5) Energia straturilor electronice:
a) Crește de la nucleu spre exterior;
b) Crește de la exterior spre nucleu ;
c) Este aceeași pt fiecare strat;
d) Crește cu sarcina nucleară.
Temă
II. Un element X (necunoscut) are pe stratul M 5 ē.Care este nr atomic al acestui element?
Temă
III. Elementul cu nr. de masă 27 are 3 ē pe stratul M. Determină nr. atomic și nr. neutronilor.
Temă
IV. Ce sarcină nucleară are atomul elementului căruia îi lipsesc 2 ē pentru a avea structura electronică a gazului rar Ar cu Z = 18?
Temă
V. Urzica conține o mare cantitate de fier(100mg fier la 100g plantă). Dacă necesarul zilnic de fier pt un adult este de 10mg, ce cantitate de urzici trebuie consumată pt a asigura necesarul zilnic de fier? Câți moli de atomi și câți atomi se găsesc în 10mg de fier?
Temă
VI. Câți electroni se găsesc în 3g C cu AC = 12 ?
Temă
VII. Completează spațiile libere din tabel:
3.5. Sinteză recapitulativă - Atomul.
important
Atomul este cea mai mică particulă dintr-o substanță care nu mai poate fi divizată prin procedee chimice obișnuite.
Structura atomului:
- Nucleul este partea centrală a atomului, alcătuit din particule numite nucleoni, și anume:
- Protoni, particule încărcate cu sarcină pozitivă, cu simbolul p+1.
- Neutroni, particule neutre din punct de vedere electric, cu simbolul n0.
- Învelișul electronic este spațiul din jurul nucleului format dintr-un nor de particule numite electroni care gravitează în jurul nucleului. Electronii sunt particule cu sarcină negativă, cu simbolul e-1 sau ē.
Prin frecarea dintre două corpuri, acestea se electrizează și se încarcă cu sarcini electrice , pozitive sau negative.
Sarcina electrică = q, este o mărime fizică care măsoară starea de electrizare a unui corp și se măsoară în C(Coulomb).
Electronul este particula cu cea mai mică sarcină , considerată unitatea naturală de sarcină şi notată cu e. El are o sarcină negativă egală cu 1,6 ∙ 10-19 C, fiind egală cu sarcina protonului, de semn opus, fiind numită sarcină electrică elementară (qe).
Sarcina unui corp ( Q ) este un multiplu întreg al sarcinii electrice elementare:
Q = n ∙ qe, unde n = nr.întreg și qe = sarcină electrică elementară = 1,6 ∙ 10-19 C .
Caracteristici ale particulelor elementare (subatomice):

Atomul este o particulă neutră din punct de vedere electric, deoarece are numărul de protoni din nucleu ( particule pozitive) egal cu numărul de electroni din învelișul electronic (particule negative), adică
nr. p+ = nr. ē
Pentru un atom definim numărul atomic (numit și sarcina nucleară sau nr. de ordine), Z, care reprezintă numărul de protoni din nucleu, care este egal cu numărul de electroni din înveliș:
Z = nr. p+ = nr. ē
Pentru orice atom se defineşte numărul de masă, A, care reprezintă numărul total de protoni şi neutroni din nucleul atomic. El reprezintă numărul întreg, cel mai apropiat de masa atomică reală a speciei respective :
A = nr. p+ + nr. n0
Numărul de neutroni din nucleu, N, se numeşte număr neutronic :
N = A – Z
Element chimic
Elementul chimic reprezintă totalitatea atomilor care au același număr atomic Z.
În prezent se cunosc 118 elemente chimice. Fiecare are o denumire și o notație prescurtată.
Simbolul chimic este litera sau grupul de două litere cu care se notează în mod convențional un element chimic.
Simbolul chimic are o dublă semnificație:
a) Calitativă - reprezintă un anumit element chimic
b) Cantitativă - la scară atomică, reprezintă un atom al elementului respectiv.
Exemple:
Mg:
a) elementul chimic magneziu
b) un atom de magneziu
3 Cl:
a) elementul chimic clor
b) trei atomi de clor
Un element chimic cu simbolul E se notează astfel:
Atenție! În sistemul periodic, în fiecare căsuță a elementului chimic, deasupra simbolului este trecut nr. atomic Z, iar sub simbol este trecut nr. de masă A, invers cum îl scriem noi pe caiet.
Izotopii sunt speciile de atomi cu același Z, dar cu A diferit.
Observaţie importantă
- Nr. atomic, Z, este numărul scris deasupra simbolului elementului chimic în tabelul periodic, de pe a doua coperta a manualului.
- Nr. de masă, A, este numărul scris sub simbolului elementului chimic în tabelul periodic, de pe a doua coperta a manualului, luat întreg prin aproximare.
- Nr. neutronic, N, se calculează cu formula : N = A – Z
Masa atomică. Mol de atomi.
Unitatea atomică de masă (u.a.m.) reprezintă a 12-a parte din masa izotopului de carbon,
Masa atomică relativă (A) este numărul care arată de câte ori masa unui atom este mai mare decât unitatea atomică de masă.
Observaţie:
Masa atomică relativă medie este valoarea trecută în tabelul periodic în dreptul simbolului fiecărui element, şi este, de obicei, un număr raţional (a nu se confunda cu numărul de masă A care este un număr întreg).
Un mol de atomi reprezintă cantitatea, în grame, dintr-o substanţă simplă care conţine 6,022 ∙ 1023 de atomi. Se mai numeşte şi atom gram. Se notează cu litera grecească ”niu”= υ.

Numărul lui Avogadro, notat cu NA, este egal cu 6,022 ∙1023 atomi şi reprezintă numărul de atomi conţinuţi într-un mol de atomi din orice element chimic.
Învelișul de electroni
Învelișul electronic reprezintă totalitatea electronilor care orbitează în jurul nucleului atomic.
Învelișul electronic are o structură stratificată, fiind format din șapte straturi (nivele) concentrice nucleului și numerotate de la nucleu către exterior cu 1, 2, 3, 4, 5, 6 şi 7 sau cu litere începând de la litera K (K, L, M, N, O, P și Q).
Într-un atom, electronii tind să ocupe pozițiile cele mai stabile, caracterizate de energia cea mai mică. Energia straturilor crește de la primul strat din jurul nucleului spre exterior. Aceasta este și ordinea de repartizare a electronilor pe straturi.

Toți electronii sunt identici pentru că au aceeași masă (9,1 ∙ 10-31 kg), aceleași dimensiuni, aceeași sarcina electrică ( q = - 1,6 ∙ 10-19 C ).
Forțele de atracție electrostatică dintre nucleul încărcat pozitiv și electronii încărcați negativ, explică mișcarea acestora în jurul nucleului.
Repartiția pe straturi a celor Z electroni ai unui atom reprezintă structura electronică a atomului.
Ocuparea straturilor cu electroni respectă anumite reguli:
electronii ocupă straturile în ordine, începând de la cel mai apropiat de nucleu;
fiecare strat conține un număr limitat de electroni;
numărul maxim de electroni de pe un nivel energetic este dat de formula:
nr max ē = 2n2,
unde n = nr. stratului
Exemplu:
a) pentru stratul K, n=1, nr max ē = 2n2 = 2 ∙ 12 = 2 electroni
b) pentru stratul L, n=2, nr max ē = 2n2 = 2 ∙ 22 = 8 electroni
c) pentru stratul M, n=3, nr max ē = 2n2 = 2 ∙ 32 = 18 electroni
Cel mai folosit model de structură a învelișului electronic este modelul Bohr, în care straturile sunt cercuri concentrice cu nucleul la mijloc.
Problemă Model
1. Reprezintă structura atomului de
Rezolvare:
În mijloc reprezentăm nucleul cu protoni ( Z = 17 = nr. p+) și neutroni ( N = A - Z = 35- 17 = 18 = nr. n0)
În jurul nucleului reprezentămŞ
- stratul 1 = K, cu maxim 2ē
- stratul 2 = L, cu max 8ē
- stratul 3 = L, cu 7ē.
În total trebuie să avem 17 ē, întrucât Z = 17 = nr. electroni din învelișul electronic.
Straturile neocupate cu electroni nu se mai desenează.

Temă
Completați pe caiet tabelul următor: