VII.IMPORTANŢA CHIMIEI ÎN VIAŢA NOASTRĂ
VII.1. Combustibili.
Definiţie
Combustibilii sunt substanțe care degajă căldură, prin arderea lor.
important
Clasificarea combustibililor :
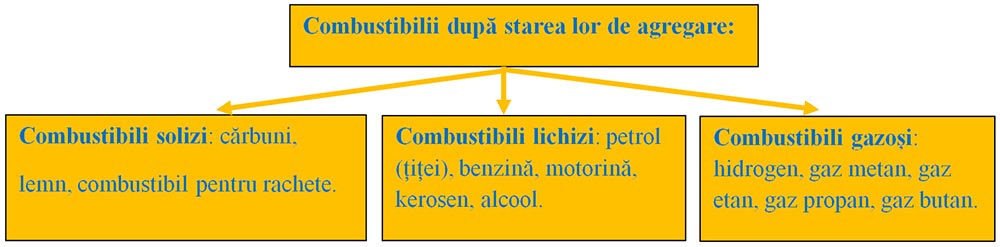
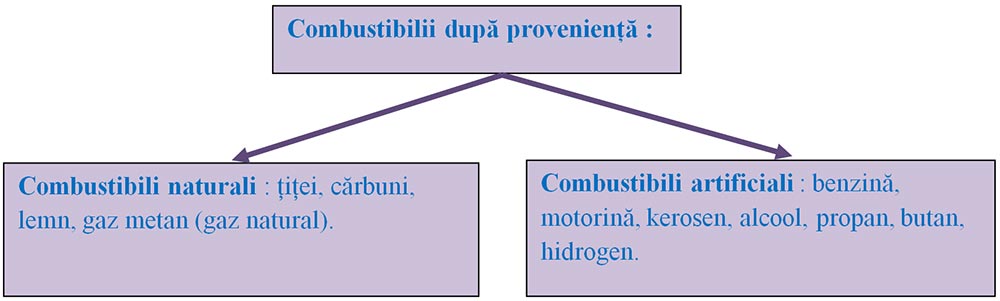
Cei mai importanți combustibili sunt:
VII.1.1. Țițeiul (petrolul brut).
Țițeiul (petrolul brut) a luat naștere din organisme marine plancton care, după moarte s-au depus pe fundul mării, fiind acoperite ulterior de sedimente.
Conform acestei teorii perioada de formare a petrolului se întinde pe perioada de timp de cca. 350 - 400 milioane de ani în urmă când a avut loc în rândurile florei și faunei o mortalitate în masă, explicată prin teoria meteoritului uriaș care a căzut în acea perioadă pe Pământ, declanșând temperaturi și presiuni ridicate.
În cazul în care straturile impermeabile de argilă sunt deasupra, nepermițând ieșirea la suprafață a petrolului, acesta se va găsi în straturile profunde de unde va fi extras prin sonde petroliere.
Petrolul este un amestec de hidrocarburi solide și gazoase dizolvate într-un amestec de hidrocarburi lichide. Țițeiul în stare brută (nerafinat) conține peste 17 000 de substanțe organice complexe. El este un lichid vâscos, a cărui culoare variază de la galben-verde pînă la negru, avînd reflexe colorate diferite. Mirosul petrolului este caracteristic. Petrolul nu este solubil în apă şi mai uşor ca aceasta. Fiind un amestec din diverși compuși, petrolul nu are punct de fierbere definitiv, el se distilează continuu, la temperaturi cuprinse între 30°C şi 360°C. Petrolul brut este considerat la fel de valoros ca şi aurul, de aceea a fost numit aurul negru.

Prin distilarea fracționată a petrolului, în rafinăriile petrochimice se obțin propan, butan, benzine, petrol lampant, motorină, păcură.

Utilizări ale petrolului
- Drept combustibil sub formă de:
- benzină;
- motorină;
- kerosen, etc.
- La obținerea de:
- vopsele și coloranți;
- medicamente;
- materiale plastice;
- cauciuc sintetic;
- fire sintetice;
- adezivi;
- detergenți;
- produse cosmetice;
- explozivi;
- insecticide și pesticide, etc.
VII.1.2. Cărbunele.
Cărbunele s-a format din resturi de plante fosile, care constau mai ales din feriga uriașă. După moartea lor, aceste plante s-aue scufundat în mlaștină unde, fiind izolate de aerul atmosferic urmează o serie de procese anaerobe (fără oxigen).
În primele faze s-a format turba.

Prin migrația mărilor, aceste mlaștini au fost acoperite cu sedimente, creându-se temperaturi și presiuni ridicate, care au eliminat apa din turbă și astfel a luat naștere cărbunele brun (lignit).

Presiunile mari au continuat să elimine apa din cărbunele brun rezultând cărbunii cu cea mai mare putere calorifică, huila.

La presiuni și mai mari s-a format antracitul care este în același timp și cărbunele cel mai vechi. La antracit procentul de carbon ajunge la 90 - 96 %.

Culoarea cărbunilor diferă de la un tip de cărbune la altul și chiar în cadrul aceluiași tip. Astfel, turbele pot fi galbene, brune și, uneori, negre. Ligniții încep de la culori galben murdare, trec prin galben-brun, brun și ajung la negru. Huilele sunt în marea lor majoritate negre, iar antraciții au culori cenușii, cenușii metalice și neagră.
Cărbunii bruni lasă, în general, urma brună, huilele urmă neagră, iar la antraciți aceasta este neagră cu nuanțe de gri metalic.
Luciul cărbunilor depinde de compoziția petrografica și crește odată cu gradul de carbonificare.
Utilizări ale cărbunelui
Drept combustibil, atât casnic, cât și în producerea de curent electric produs cu ajutorul turbinelor din termocentrale. Prin ardere, cărbunele eliberează căldură și produce gaze de ardere ca dioxid de carbon, dioxid de sulf și vapori de apă. Termocentralele moderne au redus substanțial emisiile de gaze nocive rezultate din arderea cărbunilor.
Ca materie primă în industria chimică și în metalurgie.
Cocsul este un material obținut prin prelucrarea termică a huilei. El are o importanță mare, fiind folosit drept combustibil în încălzire (înlocuitor al gazelor naturale) și de asemenea ca reducător al minereurilor feroase în furnale, la obținerea metalelor.
VII.1.3. Gazul natural.
Gazul natural este un gaz inflamabil care se află sub formă de zăcământ în straturile din adâncime ale pământului. Gazul natural este asociat cu zăcămintele de petrol, procesele lor de formare fiind asemănătoare. Gazul se formează din organisme microscopice moarte (alge, plancton) fiind izolat de aerul atmosferic, în prezența unor temperaturi și presiuni ridicate, condiții care au luat naștere prin sedimentarea pe fundul mărilor, fiind acoperite ulterior de straturi impermeabile de pământ.
În general, gazul natural are în compoziție 85% metan, 4% alți alcani (etan, propan, butan, pentan) și 11% gaze inerte (care nu ard). Deosebit de valoroase sunt gazele naturale care conțin heliu, aceste gaze fiind sursa principală de obținere a heliului.
Gazul natural este un amestec puternic inflamabil, de regulă insipid și inodor (din care cauză pentru odorizare se adaugă gazului mercaptan cu scopul de a ușura detectarea scurgerilor). Are o temperatură de aprindere de circa 600 °C. Este un gaz mai ușor ca aerul, având o densitate de 0,700–0,840 kg/m³.
Poate fi transportat prin conducte sau cu alte mijloace de transport în stare comprimată sau în stare lichidă, actualmente fiind folosit pe scară tot mai largă ca înlocuitor al benzinei.
Utilizări ale metanului
Drept combustibil
Obținerea gazului de sinteză (CO + H2)
În industria chimiei organice, la obținerea unor solvenți, agenți frigorifici, formaldehidă, acid cianhidric, negru de fum, etc., substanțe care sunt materii prime pentru alte sinteze organice. Gazul natural acoperă 24% din necesarul de energie al lumii.

VII.1.4. Hidrogenul.
Hidrogenul se consideră a fi combustibilul viitorului.
Este un gaz inflamabil, incolor, insipid, inodor, iar în natură se întâlnește mai ales sub formă de moleculă diatomică, H2. Este cel mai ușor gaz.
Cea mai importantă metodă de obținere industrilă a hidrogenului este prin reacția dintre metan și a vaporilor de apă, la tempreaturi ridicate ( 1300 – 2000 °F), rezultând un amestec numit gaz de sinteză , format din monoxid de carbon (CO) și hidrogen (H2) :
CH4 + H2O = CO + 3H2
Utilizări ale hidrogenului
- Drept combustibil, fiind o alternativă pentru înlocuirea benzinei pentru vehiculele echipate cu motoare cu ardere internă. Avantajele sale principale constau în faptul că este ecologic, din arderea sa rezultând vapori de apă, iar randamentul termic al motoarelor cu hidrogen este ridicat. Dezavantajele constau în pericolul mare de explozie, dificultatea stocării în vehicul și lipsa unor rețele de stații de alimentare cu hidrogen. Una dintre cele mai promițătoare soluții tehnice o reprezintă conversia directă a energiei chimice din hidrogen în electricitate, prin intermediul pilelor de combustie (electroliza apei acidulate).

- Umplerea baloanelor meteorologice.

- Ca reactant, de reducere a minereurilor oxizilor metalici pentru obținerea metalelor, de fabricare a amoniacului și în procedeele de hidrogenare.

- Flacăra oxihidrică folosită la sudura și tăierea metalelor pentru lucrări sub apă la adâncime mai mare de 100m. În amestec cu oxigenul, hidrogenul arde cu o flacără pală albăstruie, aproape invizibilă, dar foarte fierbinte.

- Datorită bunei conductivități termice este folosit ca agent de răcire în generatoare electrice din centralele electrice.De asemenea, izotopul radioactiv al hidrogenului, deuteriu, este folosit la obținerea apei grele. Apa grea este utilizată în special ca moderator de neutroni în reactori nucleari printre care și cei de tip CANDU folosite la Cernavodă. În domeniul științific, o altă utilizare este în detectoarele de neutroni.

- Hidrogenul lichid are un rol important în cercetările din criogenie, inclusiv în studiile legate de superconductivitate.
VII.2. Arderea - proces exoterm.
Definiție
Căldura degajată de un combustibil prin ardere depinde de masa combustibilului ( m ) și de puterea calorică a combustibilului ( q) și are următoarea formulă :

m = masa (cantitatea) de combustibil ars (kg)
q = puterea calorică a combustibilului (kJ/kg).
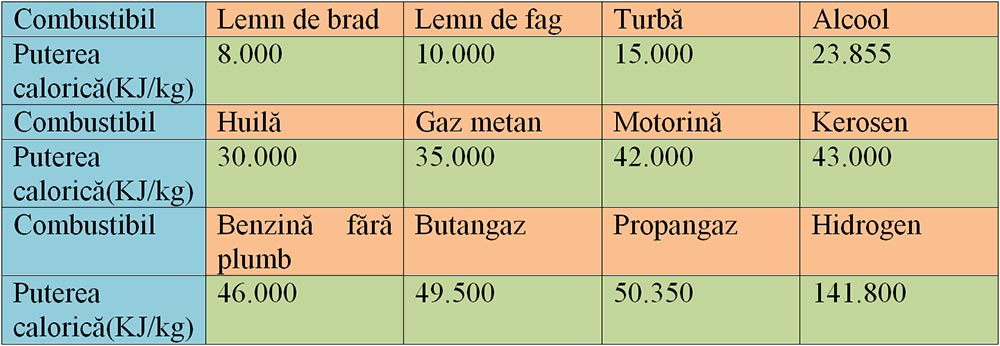
Fiecare combustibil este caracterizat de o constantă de material, numită putere calorică (notată cu q), pe care o luăm din tabelul următor.
Experiment
1. Depinde căldura cedată de un combustibil de masa lui?
Materiale necesare: pahar Erlenmeyer, apă rece de la robinet, spirtieră, sită de azbest, trepied, termometru, alcool.
Atenţie
Atenție când lucrezi cu surse de foc! Fă experimentul numai în prezenţa unui părinte!
Descrierea experimentului:
Pune într-un pahar 100g de apă și introdu în apă un termometru și măsoară temperatura inițială T1 = 30°C.
Pune în spirtieră alcool și determină-i masa, m1 = 136,1g.
Încălzește la flacăra acestei spirtiere, apa prin intermediul sitei de azbest de pe trepied, până se încălzește cu 10°C, adică până la 40°C. Stinge spirtiera.
Măsoară masa spirtierei după ce ai încălzit apa cu 10°C : m2 = 134,9g.
Calculează cantitatea de alcool arsă: mI = m2 – m1 = 1,2 g alcool.
Pune într-un pahar 100g de apă și introdu în apă un termometru și măsoară temperatura inițială T1 = 31°C.
Pune în spirtieră alcool și determină-i masa, m1 = 136,1g.
Încălzește la flacăra acestei spirtiere, apa prin intermediul sitei de azbest de pe trepied, până se încălzește cu 20°C, adică până la 51°C. Stinge spirtiera.
Măsoară masa spirtierei după ce ai încălzit apa cu 20°C : m2 = 134,1g.
Calculează cantitatea de alcool arsă : mII = m2 – m1 = 2 g alcool.
Depinde căldura absorbită de apă de cantitatea de combustibil folosită ?
Ce observi ?
Observaţie
2 g de alcool încălzește mai mult apa decât 1,2 g de alcool.
Concluzia experimentului:
Căldura cedată de un combustibil, prin arderea sa, este direct proporțională cu masa combustibilului: Q ~ m.
Experiment
2. Depinde căldura degajată de un combustibil de felul acestuia?
Materiale necesare: pahar Erlenmeyer, apă rece de la robinet, spirtieră, sită de azbest, trepied, termometru, alcool, cronometru, aragaz
Atenţie
Atenție când lucrezi cu surse de foc! Fă experimentul numai în prezenţa unui părinte!
Descrierea experimentului:
Măsoară cu cronometrul timpul în care încălzești 100 g de apă cu 20°C cu ajutorul spirtierei umplută cu alcool: t1 = 2min 28,54s.
Măsoară cu cronometrul timpul în care încălzești 100 g de apă cu 20°C cu ajutorul gazului metan de la aragaz: t2 = 1min 1,72s
Depinde căldura absorbită de apă de felul combustibilului folosit ?
Ce observi ?
Observaţie
Gazul metan încălzește mai repede apa decât spirtul.
Concluzia experimentului:
Căldura cedată de un combustibil, prin arderea sa, este direct proporțională cu felul combustibilului.
important
Arderea combustibililor este un proces exoterm deoarece se degajă o cantitate mare de căldură (Q).

Arderea metanului este completă dacă elementele care intră în alcătuirea sa, carbonul și hidrogenul, se transformă în dioxid de carbon și apă, iar flacăra are culoare albăstruie.
Arderea metanului este incompletă când are loc într-o cantitate insuficientă de oxigen sau de aer, cu degajare de monoxid de carbon, cu flacără roșiatică.

Atenție
Atenție, dacă gazul arde cu o flacără roșie este bine să chemați un tehnician calificat pentru o inspecție tehnică a aragazului (garnitura de aer, duzele arzătorului) și pentru reglarea amestecului aer-gaz metan!!!
Nu efectuați improvizații la sobe sau mașini de gătit !!!
Monoxid de carbon este un produs secundar al oricărei combustii, pe lângă dioxidul de carbon. Flacără portocalie sau roșie indică o prezență crescută a monoxidului de carbon în gazele de ardere. Fiind fără culoare (incolor), fără miros (inodor) și fără gust (insipid) este un ucigaș tăcut.
După ce monoxidul de carbon este inhalat, acesta intră în fluxul sanguin și se amestecă cu hemoglobina (care transportă oxigenul în corp) formând carboxihemoglobina. Când se întâmplă acest lucru, sângele nu mai este capabil să transporte oxigen, iar această lipsă de oxigen face ca celulele și țesuturile corpului să moară.
Atenție
Simptomele otrăvirii cu monoxid de carbon sunt dureri de cap (cefalee), amețeli, greață. Dacă intoxicatul nu este scos din incinta cu monoxid de carbon, apare leșinul și, în final, moartea.
Avertizare
Eu și familia mea ne-am intoxicat cu monoxid de carbon de la o improvizație la soba din bucătărie. Cu toții am fost la un pas de moarte.
Acea zi nu o voi uita niciodată. Am început să avem amețeli, dureri de cap. După o oră am căzut toți pe podea fără cunoștință.
Am avut noroc cu un vecin care a anunțat salvarea. După ce ne-a acordat prim ajutor și ne-a pus perfuzii la spital am început să ne simțim mai bine.
Însă efectele intoxicării cu monoxid de carbon au durat un timp destul de lung. Lecția mi-a fost învățată și acum o predau teoretic și copiilor la școală.
Cele mai frecvente cauze ale expunerii accidentale la monoxid de carbon sunt :
aparatele de uz casnic instalate incorect, slab întreținute sau slab ventilate, cum ar fi aragazele, încălzitoarele și cazanele de încălzire centrală.
improvizații la sobă și aragaz.
în rulote, bărci și case mobile, riscul expunerii la monoxid de carbon de la dispozitivele portabile poate fi, de asemenea, mai mare.
coșurile de fum și șemineele blocate pot opri evacuarea monoxidului de carbon, permițându-i să atingă niveluri periculoase.
arderea combustibilului într-un spațiu închis sau neventilat , de exemplu funcționarea unui motor auto, un generator pe benzină sau un grătar în interiorul unui garaj sau un cazan defect într-o bucătărie închisă.
eșapamente defecte sau blocate ale mașinii – o scurgere sau blocaj în conducta de eșapament, cum ar fi după ninsori abundente, ar putea duce la acumularea de monoxid de carbon în interiorul mașinii.
Atenție
Instalarea aragazurilor, a centralelor termice și a sobelor trebuie făcută numai de specialiști!!!
VII.3. Impactul produșilor de ardere asupra mediului și asupra organismului uman.
Termocentralele transformă căldura degajată prin arderea unui combustibil (cărbune, gaze naturale) în energie electrică. Prin încălzirea apei dintr-un cazan se produce abur sub presiune care pune în mișcare roata turbinei . În cadrul generatorului, mișcarea unei bobine într-un câmp magnetic, produce curent electric.

La arderea cărbunilor, o parte dintre elementele componente ale acestora (sulf, azot) eliberează în mediul înconjurător compuși care afectează mediul înconjurător. În mod similar, gazele de eșapament de la autoturisme, camioane și autobuze eliberează dioxidul de sulf și oxidul de azot în aer.
- Sulful prin ardere (reacția cu oxigenul) se transformă în dioxid de sulf, care reacționează cu apa din atmosferă formând acid sulfuros :
S + O2 = SO2 ↑
SO2 + H2O = H2SO3
- Azotul din cărbuni se transformă în dioxid de azot, care reacționează cu apă formând acid azotic :
N + O2 = NO2 ↑
4NO2 + 2H2O + O2 = 4HNO3
Definiție
Ploile acide sunt precipitațiile care au un pH mai mic decât 5,6, având un caracter acid pronunțat.
Ploaia nepoluată este slab acidă cu un pH mai mic de 7, dar nu mai mic de 5,6.
Experiment
3. Ce este ploaia acidă ?
Materiale necesare: pahar Erlenmeyer prevăzut cu dop și tub, pahar Erlenmeyer cu apă, hârtie de pH, o țesătură, calcar, frunză, acid azotic concentrat, granulă de cupru.
Atenţie
Atenție când lucrezi cu surse de foc! Fă experimentul numai în prezenţa unui părinte!
Descrierea experimentului (Partea 1):
Pune acidul azotic și granula de cupru în paharul Erlenmeyer și astupă repede cu dopul prevăzut cu tub.
Așază tubul în paharul cu apă astfel încât dioxidul de azot rezultat în urma reacției dintre HNO3 și Cu să intre în apă.
După terminarea reacției pune în paharul cu apă în care ai barbotat NO2 hârtia de pH, frunza și bucata de țesătură.
Ce observi ?
Observaţie (Partea 1)
Hârtia de pH arată un pH = 5.
Concluzia experimentului (Partea 1):
Dioxidul de azot cu apă și oxigenul din aer formează acid azotic.
4NO2 + 2H2O + O2 = 4HNO3
Ploaia cu dioxidul de azot din aer formează un acid , având un caracter acid pronunțat.
Descrierea experimentului (Partea 2):
Lasă frunza, calcarul și țesătura mai multe zile în apa cu acidul azotic format.
Ce observi ?
Observaţie (Partea 2)
Frunza s-a pătat, țesătura s-a decolorat, iar calcarul a devenit sfărâmicios.
Concluzia experimentului (Partea 2):
Ploaia acidă este o precipitație cu caracter acid(amestec de acid azotic cu acid sulfuros), având un pH mai mic decât 5,6 și care se formează prin reacția apei de ploaie cu oxizii de azot și de sulf din aerul poluat.

EFECTELE PLOILOR ACIDE
1) EFECTUL ASUPRA ATMOSFEREI
Constituenții poluarii acide există ca particule în aer și contribuie la formarea ceții (smogului), afectând vizibilitatea. Aceasta face deplasarea dificilă, în special pentru piloți. Ceața acidă împiedică de asemenea cursul luminii solare de la soare la pământ și înapoi. În zona arctică, aceasta afectează creșterea lichenilor, care la rândul ei, afectează renii și alte animale care se hrănesc cu licheni.

2) EFECTUL ASUPRA ARHITECTURII
Ploile acide sunt un pericol constant şi la adresa clădirilor şi monumentelor istorice ridicate de om. În special statuile sau edificiile din marmură sau calcar, roci care conţin cantităţi mari de carbonat de calciu, sunt afectate de aciditatea crescută a precipitaţiilor. Acizii din picăturile de ploaie reacţionează în timp cu compuşii de calciu din aceste roci, ceea ce duce la apariţia unui strat de gips (sulfat de calciu, care este sfărâmicios). Nici metalele nu sunt cruţate: ploile acide distrug straturile protectoare de vopsea şi corodează metalul. În special fierul, oţelurile, cuprul şi bronzul sunt vulnerabile la acţiunea picăturile acide.

3) EFECTUL ASUPRA MATERIALELOR
Ploaia acidă distruge și materialele precum țesăturile. De exemplu, steagurile arborate sunt “mâncate” de chimicalele acide din precipitatii. Cărțile si obiectele de artă, vechi de sute de ani, sunt de asemenea afectate. Sistemele de ventilație ale librăriilor și muzeelor, în care sunt ținute acestea, nu previn intrarea particulelor acide în clădiri și astfel ele intră, circulă și deteriorează materialele.

4) EFECTUL ASUPRA OAMENILOR
Unele dintre cele mai serioase efecte ale ploii acide asupra oamenilor sunt problemele respiratorii. Emisiile de dioxid de sulf și dioxid de azot dau naștere unor probleme medicale precum tusea, astmul, dureri de cap, iritații ale ochilor, nasului și gâtului.

5) EFECTUL ASUPRA COPACILOR ȘI SOLURILOR
Unul dintre cele mai serioase impacte ale precipitațiilor acide este cel asupra pădurilor și solurilor. Pagube majore se produc atunci cand acidul sulfuric cade pe pamant sub forma de ploaie. Substanțele nutritive aflate în soluri sunt îndepartate. Aluminiul, de asemenea prezent în sol este eliberat și acest element toxic poate fi absorbit de rădăcinile copacilor. Astfel, copacii sunt sortiți morții, fiind privați de nutritivi vitali, precum calciul și magneziul.

6) EFECTUL ASUPRA LACURILOR ȘI ECOSISTEMELOR ACVATICE
Ploaia acidă care cade pe pământ, spală substanțele nutritive din sol și poartă metalele toxice eliberate din sol spre lacuri.
O altă cale prin care acizii ajung în lacuri se petrece primavara, prin topirea zăpezilor, când acizii și chimicalele pătrund în sol, fiind purtate spre râuri și lacuri. Aceasta cauzează o schimbare drastică a pH-ului lacurilor. Multe dintre aceste specii își depun ouăle în apă. La un nivel al pH-ului de 5, majoritatea ouălor de pește nu vor supraviețui, iar la un nivel mai scăzut de pH, peștii adulți pot muri. Peștii, fiind membrii primari ai lanțului trofic, reprezintă hrana pentru multe specii de animale, printre care se numără și omul.

Dintre gazele rezultate în procesele de ardere a combustibililor, dioxidul de carbon contribuie cel mai mult la producerea efectului de seră, dar și freonii, metanul, etanul, oxizii de azot, oxizii de sulf, ozonul,etc.
Aceste gaze din atmosfera Pământului se comportă ca pereții unei sere - captează și rețin căldura soarelui reflectată de Pământ, astfel încât aceasta nu mai este eliberată înapoi spațiu.
Definiție
Efectul de seră este procesul de încălzire a planetei din cauza razelor reflectate de gazele de seră din atmosferă înapoi spre suprafața Pământului.
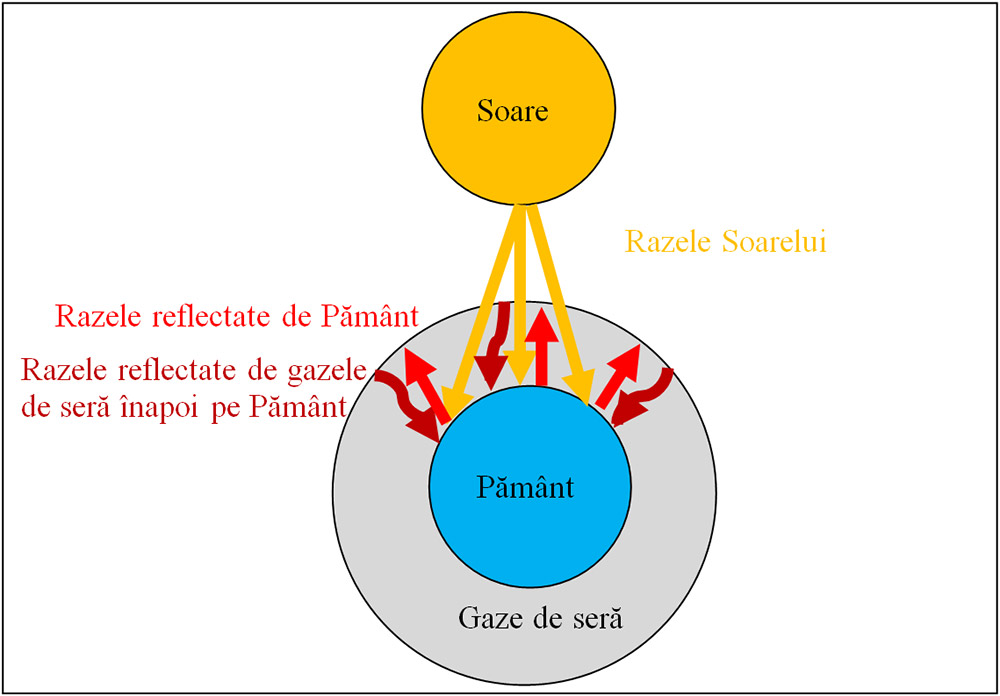
Cauza principală a efectului de seră constă în acea cantitate enormă de dioxid de carbon și altor substanțe cu efect de seră ce se acumulează în stratul aerian formând o „plapumă”. Ele dau posibilitate razelor ultraviolete și infraroșii de la Soare să treacă foarte ușor, ajungând la suprafața solului. Aceste raze se transformă în energie termică, iar energia termică de la suprafața solului prin acest strat trece mult mai greu în așa fel încât se creează situația – cu cât plapuma este mai groasă cu atât sub ea este mai cald.
Experiment
4. Efectul de seră
Materiale necesare: 2 borcane (pahare), termometru, folie de plastic, calorifer.
Descrierea experimentului:
Măsoară temperatura apei de la robinetul de apă rece.
Pune aceeași cantitate de apă în fiecare borcan.
Acoperă unul dintre borcane cu o folie de plastic și așază-le pe un calorifer. Dacă este Soare, așază cele două borcane în bătaia razelor solare.
Măsoară temperatura apei din cele două borcane după aproximativ o oră.
Cum sunt temperaturile apei din cele două borcane ?
Observaţie
Temperatura apei din borcanul acoperit cu folie este mai mare decât cea a apei din borcanul neacoperit.
Concluzia experimentului:
Folia de plastic acționează asemănător cu folia care acoperă o seră. În același mod, gazele cu efect de seră păstrează o parte din căldura provenită de la soare. Borcanul cu apă joacă rolul Pământului care reflectă radiația infraroșie primită de la Soare. Folia de plastic joacă rolul gazelor de seră care întorc (reflectă) radiația reflectată de Pământ, ducând la încălzirea globală a Pământului.
Din cauza efectului de seră se așteaptă ca, temperatura globală să crească, fapt care are multe consecințe dezastroase:
- schimbarea tiparul climatic,
- afectarea producției agricole,
- modificare distribuției animalelor și plantelor,
- topirea ghețarilor și creșterea nivelul mării.
Astfel, în 2016 a avut loc Acordul de la Paris, o înțelegere între 73 de țări care are ca scop păstrarea creșterii temperaturii globale sub două grade Celsius și scăderea emisiilor de dioxid de carbon provenite din arderea de combustibili fosili.
Măsuri de prevenire a formării ploilor acide și a combaterii efectului de seră:
Tot mai multe termocentrale pe cărbuni folosesc tehnologii de desulfurizare, pentru a "curăţa" gazele emise de sulf. O astfel de staţie de desulfurizare poate elimina circa 95% din conţinutul de sulf al gazelor emise în atmosferă.
Folosirea mașinilor ecologice, a bicicletelor și trotinetelor electrice.
Îmbunătățirea calității carburanților.
Folosirea transportului în comun.
Reducerea consumului de energie prin achiziționarea de aparate electrocasnice care consumă puțină energie electrică ( clasa A) și oprirea aparatelor și becurilor când nu avem nevoie de ele.
VII.4. Energia corpului omenesc prin arderea glucozei.
De unde își ia omul energie? Hrana este principala sursă de energie a tuturor ființelor.
În principal alimentele conțin trei mari categorii de substanțe organice:
- zaharide(zaharuri),
- lipide (grăsimi) și
- proteine.
Toate acestea, prin ardere cu oxigenul din sânge, dau energia necesară omului.
Zaharidele sau glucidele (hidrații de carbon) sunt:
- glucoza,
- zaharoza și
- amidonul.
Când lumina Soarelui cade pe frunzele plantelor, clorofila transformă apa și dioxidul de carbon în glucoză (C6H12O6) și oxigen.

Glucoza produsă de plante prin fotosinteză este transformată în alți compuși, precum celuloza și amidonul. Tulpinile plantelor, trunchiul copacilor conțin celuloză, iar amidonul se depozitează în rădăcini sau semințe. Amidonul servește drept hrană pentru oameni.
Când mâncăm, organismul transformă o parte din alimente în glucoză, pe care o trimite în sânge. Glucoza este folosită imediat pentru asigurarea energiei necesare organismului sau este stocată pentru a fi utilizată mai târziu. Rezerva de glucoză este depozitată în ficat. Când cantitatea de glucoză din sânge este prea mare, omul are diabet.
important
Reacția de ardere a glucozei este o reacția exotermă, obținându-se dioxid de carbon, apă și energie (Q) care se va trece la produșii de reacție:
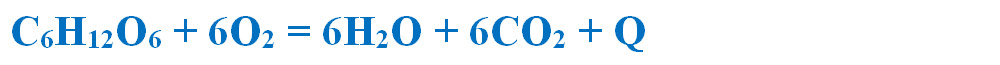
Aplicații
Glucoza este prezentă în fructe dulci, legume, în dulciuri și produse alimentare care conțin amidon: cartofi, orez, cereale de orice fel, paste, pâine. Glucoza poate fi obținută de organism din orice aliment și are o importanță deosebită pentru om, fiind principala sursă de energie a acestuia.
Glucoza se folosește la obținerea alcoolului etilic, la obținerea oglinzilor, în alimentație ca înlocuitor al zahărului, în medicină pentru perfuzii, etc.
Experiment
5. Argintarea eprubetei cu glucoză?
Materiale necesare: eprubetă foarte curată, azotat de argint, soluție de amoniac, soluție de glucăză, spirtieră, clește de lemn, pahar cu apă caldă, trepied, sită azbest.
Descrierea experimentului:
Pune cu spatula câteva cristale de azotat de argint în eprubetă și adaugă soluție de amoniac până când precipitatul format se dizolvă.
Adaugă 2-3 mL de soluție de glucoză.
Introdu eprubeta într-un pahar cu apă caldă așezat pe sita cu trepied, la flacăra spirtierei.
Ce observi ?
Observaţie
Pe pereții eprubetei se depune argint.
Concluzia experimentului:
Prin reacția dintre glucoză și azotatul de argint amoniacal se obține o oglindă de argint.
Aplicații
Unitatea de măsură pentru energie este joulul (J).
O altă unitate de măsură pentru energie este caloria: 1 cal = 4,18 J
Noi, oamenii, spunem de multe ori că suntem plini de energie și suntem capabili să facem eforturi pentru diferite activități : desenare, alergare, jocuri, învățare și alte activități fizice sau intelectuale. Fiecare tip de activitate este caracterizat de un anumit consum de energie.
Exemple de costuri energetice pentru o oră pentru un adult:
Chiar și când dormim consumăm o energie de 200 kJ ( 45 calorii);
Cititul sau scrisul consumă 500 kJ;
Mersul pe jos: 900 kJ;
Mersul cu bicicleta: 1000 kJ (260 kcal)
Patinaj pe gheață sau pe role: 2000 kJ ( 480 kcal)
Alergarea: 2100 kJ;
Înotul: 2400 kJ
Fotbal: 2600 kJ ( 620 kcal)
Când suntem obosiți, spunem că nu mai avem energie și capacitatea noastră de a desfășura diferite activități scade foarte mult.
VII.5. Descompunerea termică a calcarului – proces endoterm.
important
Carbonatul de calciu, CaCO3, numit și calcar sau piatră de var, prin încălzire la temperatură ridicată, se descompune în oxid de calciu(var stins) și dioxid de carbon, conform reacției :
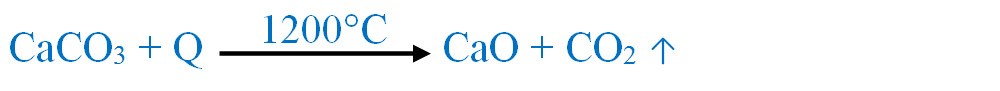
Aplicații
Această reacție are aplicații la obținerea varului, folosit în construcții.
important
Reacțiile de descompunere termică sunt reacții endoterme care au loc cu absorbție de căldură. Căldura(Q) apare scrisă la reactanți( în partea stângă a reacției).
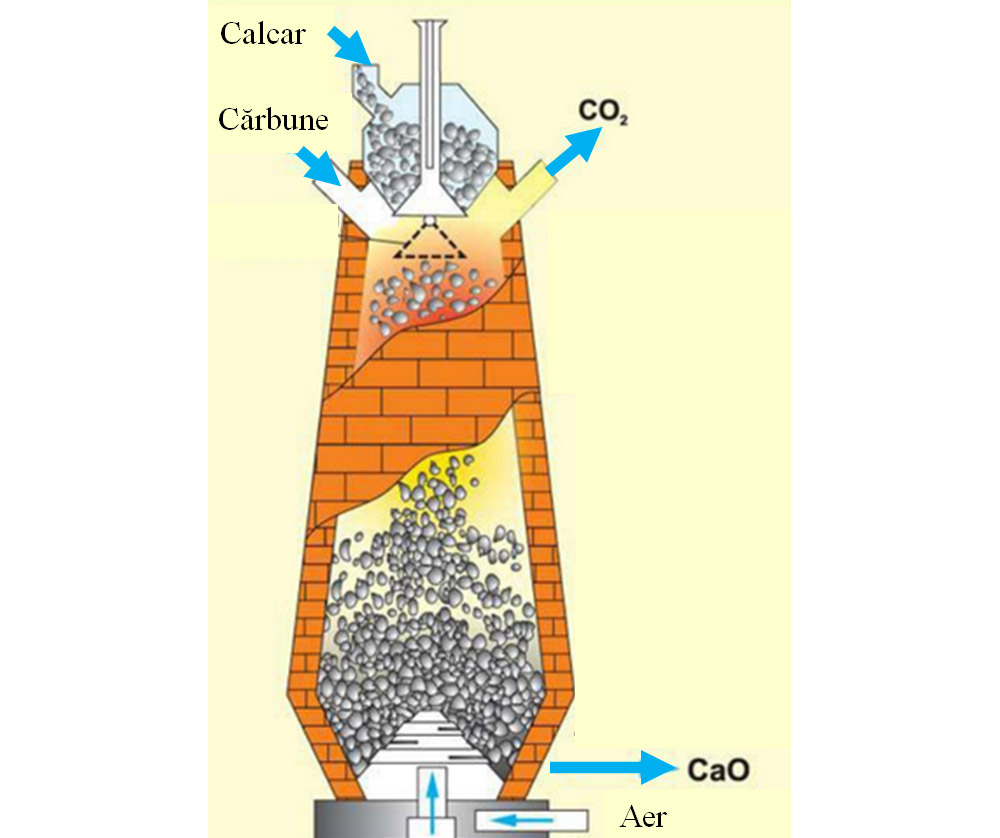
În cuptorul de var, carbonatul de calciu se transformă în oxid de calciu, denumit var nestins și dioxid de carbon, la o temperatură de 1200°C. Căldura necesară acestui proces se obține prin arderea cărbunelui, care este o reacție exotermă :
C + O2 = CO2 ↑ + Q
Calcar

VII.6. Materiale de construcție.
Definiție
Materialele de construcție reprezintă totalitatea materialelor care contribuie la execuția unei construcții.Cele mai importante materiale de construcții sunt cărămida, cimentul, sticla și betonul.
- Cărămida
Cea mai veche formă de cărămidă a fost realizată din nămol întărit, datează din anul 7500 î.Hr. și a fost descoperită în regiunea văii superioare a fluviului Tigru. Primele cărămizi uscate de soare au fost făcute în Mesopotamia, în jurul anului 4000 î.Hr. Alte exemple de civilizații care au folosit cărămida sunt egiptenii antici, romanii și chinezii.
Definiție
Cărămida este un material de construcție artificial, de formă prismatică, obținut dintr-un amestec de argilă, nisip și apă sau din alte materiale (beton, zgură de furnal etc.), uscat la soare sau ars în cuptor.
Cărămizile nearse poartă denumirea de chirpici.

Aplicații
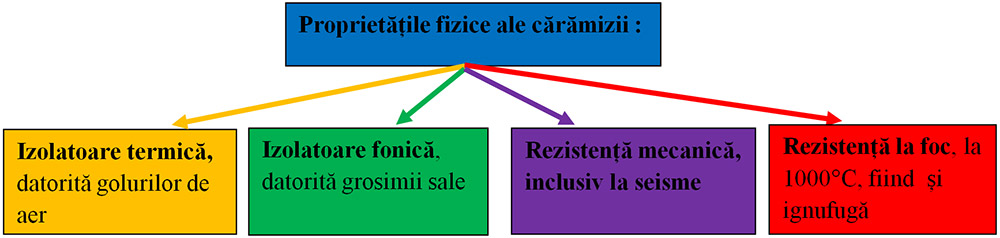
Cărămida este utilizată în domeniul construcțiilor deoarece acest material este rezistent la presiune și umiditate.
- Cimentul
Cimentul este o pulbere gri, care conține oxid de calciu și argilă. Cimentul este folosit în principal pentru producerea de mortar și beton.
Producția cimentului începe în cariera de calcar, cu excavarea pietrei de calcar și a argilei. Apoi, acestea sunt sfărâmate în bucăți de mărimea unei monede. Aceste materii prime, împreună cu un material care are aport de fier, sunt omogenizate într-o pudră, numită ”făină brută”. Făina brută este încălzită la o temperatură de 1.450 ˚C. Temperatura înaltă transformă făina într-un material nou, numit clincher.
Clincherul este răcit brusc, fiind apoi măcinat împreună cu gipsul într-o pulbere fină. Acesta este cimentul Portland. Pentru obținerea diferitelor tipuri de ciment se adaugă zgură și/sau cenușă de termocentrală (material ce rezultă din arderea cărbunelui sau a altor materiale de proveniență minerală).
Primul ciment a fost fabricat de romani.
Cimentul amestecat cu nisip și cu apă formează un amestec care se întărește, numit mortar. Acesta se utilizează ca liant, fiind capabil de a lega cărămizile între ele pentru a forma elemente de construcții.

- Betonul
Betonul este o piatră artificială, care, asemenea pietrei naturale, rezistă bine la uzură. Prin amestecul cimentului cu nisip, pietriș, alți aditivi și apă obținem beton – cel mai folosit material de construcții din lume.

-Sticla
Sticla este un material solid, amorf (fără structură cristalină), de obicei transparent, rezistență mecanică și duritate mare.
Sticla era cunoscută în Orient din anul 4000 î.Hr.
Sticla de geam se obține prin topirea unui amestec format din nisip(dioxid de siliciu), sodă, calcar și alți aditivi. Sticla de sodiu are compoziția aproximativă 6SiO2•CaO•Na2O. Se întrebuințează la fabricarea geamurilor și a ambalajelor de sticlă. Sticla de potasiu are compoziția 6SiO2•CaO•K2O și este rezistentă la variații de temperatură. Se folosește la fabricarea vaselor de laborator.

-Cristalul (sticlă de plumb)
Cristalul (sticlă de plumb) este o sticlă în care sodiul și calciul s-au înlocuit cu potasiu și plumb (6SiO2•PbO•K2O) și se caracterizează prin proprietăți de refracție bune și densitate mare. Flintul și ștrasul conțin un procent de plumb mai mare decât cristalul. Flintul se folosește pentru prisme și lentile optice.

-Sticla Jena, Pyrex sau Duran
Sticla Jena, Pyrex sau Duran se obține prin adăugarea unor cantități mici de oxid de aluminiu (Al2O3) sau trioxid de bor (B2O3) se obțin sticle rezistente la variații bruște de temperatură care se folosesc la fabricarea vaselor de laborator. Au o rezistență chimică mare și un coeficient de dilatare mic.

-Sticlele colorate
Sticlele colorate se obțin dacă se adaugă în topitură unii oxizi metalici (de Fe,Co,Cr,Cu etc.), care formeaza silicatii colorați. În industria sticlei se utilizează drept coloranți un număr foarte mare de substanțe care se încadrează de obicei în trei categorii: coloranții ionici, coloranții moleculari și coloranții coloidali. Sticlele colorate se utilizează, în afara obiectelor de menaj, în numeroase domenii importante. Sticla colorată se folosește în transporturile aeriene, navele, terestre. (semnalizări luminoase), filtre pentru anumite radiații, pentru protejarea ochilor sudorilor, filtre colorate la aparate optice sau de analiză, ca decor, etc.

VII.7. Importanța ionilor metalici pentru organismul uman. Ioni metalici toxici pentru om.
Organismul uman este alcătuit din aproximativ 25 de elemente chimice. Dintre acestea, oxigenul reprezintă aproximativ 65%, carbonul 18,5%, hidrogenul 9,5% și azotul 3,2%. Urmează un grup de elemente care se găsesc în procente cuprinse între 0,1% și 1,5%, numite oligoelemente.
Oligoelementele sunt elemente chimice care se găsesc și intervin în cantități infime în metabolismul ființelor, îndeplinind, în unele procese biologice, rolul de catalizator, fiind astfel necesar pentru dezvoltarea lor. Dintre acestea, importanță deosebită o au unele metale prezente sub formă ionică în lichidele intra și extracelulare și anume ionii de sodiu, de potasiu, de calciu, de magneziu, de fier și de cobalt, etc.
Importanța unor ioni metalici :
1) Ionul de sodiu(Na+1):
reglarea distribuției apei în organism;
contribuie la buna funcționare a sistemelor nervos și muscular;
contribuie la absorbția ionilor de calciu în sânge;
mărește rezistența organismului la efort fizic sau nervos.

2) Ionul de potasiu(K+1):
are rol important în transmiterea influxului nervos, în contracția musculară;
alături de calciu şi magneziu, controlează contracţia miocardului.
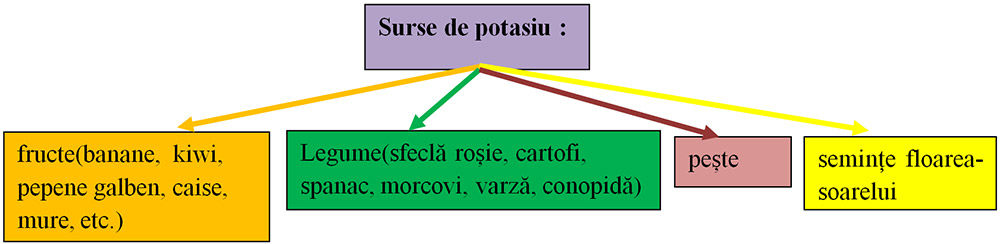

3) Ionul de calciu(Ca+2):
are importanță deosebită în formarea sistemului osos și a danturii;
contribuie la reglarea bătăilor inimii, reglează tensiunea arterială;
are rol în coagularea sângelui.

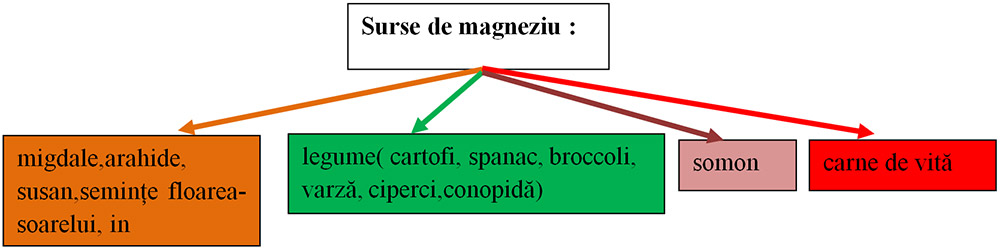
4) Ionul de magneziu(Mg+2):
contribuie la menținerea unui nivel optim de glucoză în sânge;
acționează asupra mușchilor;
contribuie la sănătatea sistemului osos prin rolul pe care îl are în procesul de absorbție a calciului;
ajută la menținerea unui nivel de energie optim;
sistem imunitar sănătos.

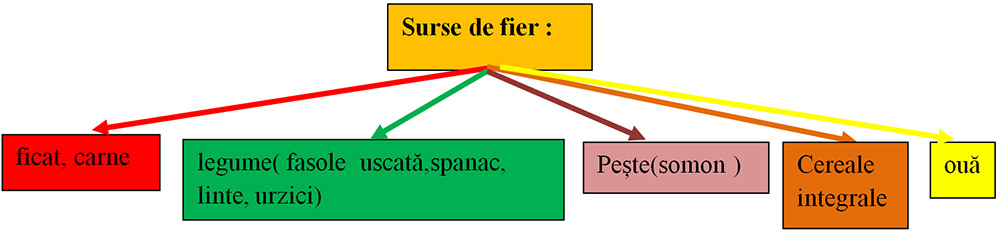
5) Ionul de fier(Fe+2):
este necesar pentru formarea hemoglobinei;
asigură secreția gastrică și respirația celulară;
are acțiune antioxidantă;
ajută la creșterea armonioasă.

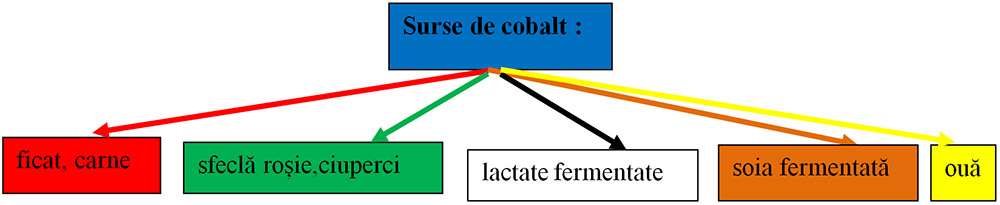
6) Ionul de cobalt(Co+2): se manifestă prin rolul său în vitamina B12, numită şi cobalamină.
- Aceasta are rol în funcţionarea sistemelor hematologic şi nervos, având rol în sinteza hemoglobinei.

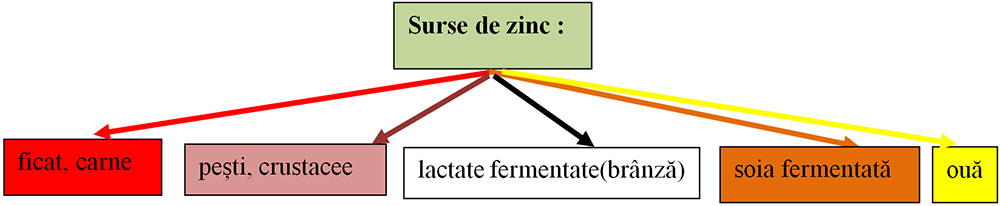
7) Ionul de zinc(Zn+2):
sinteza colagenului care contribuie la refacerea pielii, creșterea părului,unghiilor, etc.
mărește imunitatea;
descompunerea alcoolului.

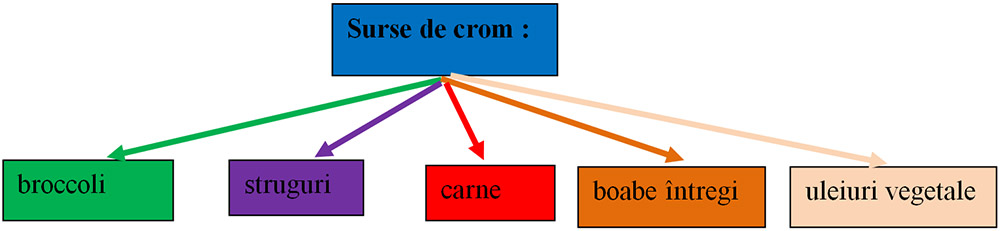
8) Ionul de crom (Cr+2) :
- Metabolismul glucozei.

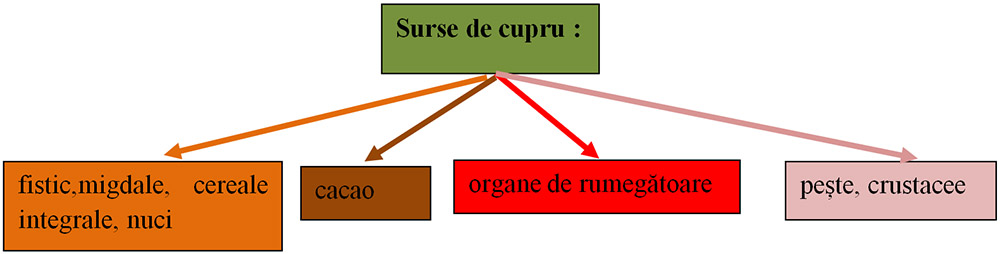
9) Ionul de cupru (Cu+2):
funcționarea sistemelor nervoase, imune și circulatorii ale corpului;
la elasticitatea vaselor de sânge și la funcțiile de formare a colagenului, care este o componentă structurală importantă a pielii și a oaselor.

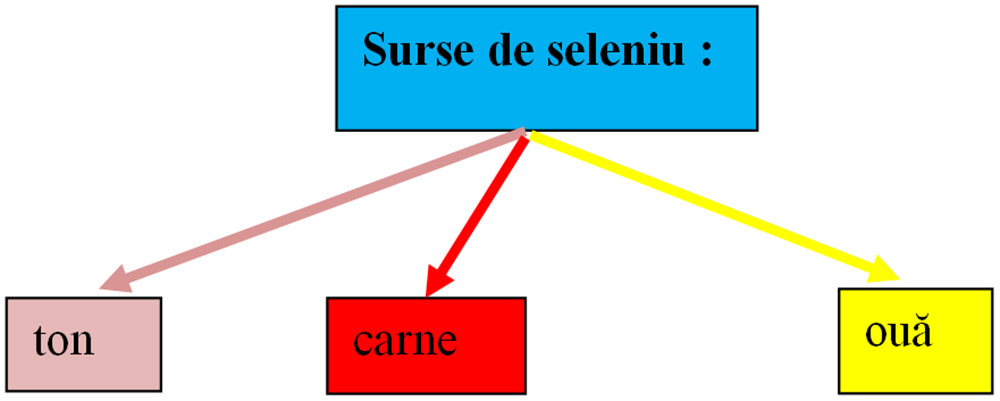
10) Ionul de seleniu(Se+2):
- Componentă în 30-50 proteine de seleniu pentru mărirea imunității.

important
În concluzie, alimentația este cea mai importantă pentru o sănătate de fier și o bună vitalitate.
Alimentația omului trebuie să fie diversă, bogată în fructe și legume proaspete, ouă, lactate și carne slabă în grăsimi, pește, semințe, etc.
Ioni metalici toxici pentru om.
Metalele grele (care au masa atomică mare) sunt considerate ca importanţi poluanţi toxici, care intrând în circuitele biogeochimice se acumulează în ecosisteme naturale şi artificiale. Metalele sunt eliberate continuu în biosferă de erupţii vulcanice, intemperii naturale de roci, dar de asemenea, de numeroase activităţi umane ca mineritul, arderea combustibililor fosili, apă uzată industrială şi urbană şi a practicilor agricole (fertilizatorii din agricultură și a hormonilor de creștere în zootehnie și piscicultură, a fungicidelor și pesticidelor), deșeurile industriale, emisiile auto, au ca efect acumularea de substanțe toxice în organismele vii.
Asimilate de organismele vegetale și de microplancton, metalele grele se acumulează pe traseul lanțurilor trofice, ajungând, adesea, în cantități dăunătoare în organismul uman.
Toxicitatea compușilor de plumb depinde de solubilitatea în apă și în acizi dar și în sânge. Carbonatul bazic de plumb fiind foarte solubil în plasmă este cel mai toxic compus al plumbului. În schimb silicații și sulfura de plumb, insolubili, nu sunt toxici.


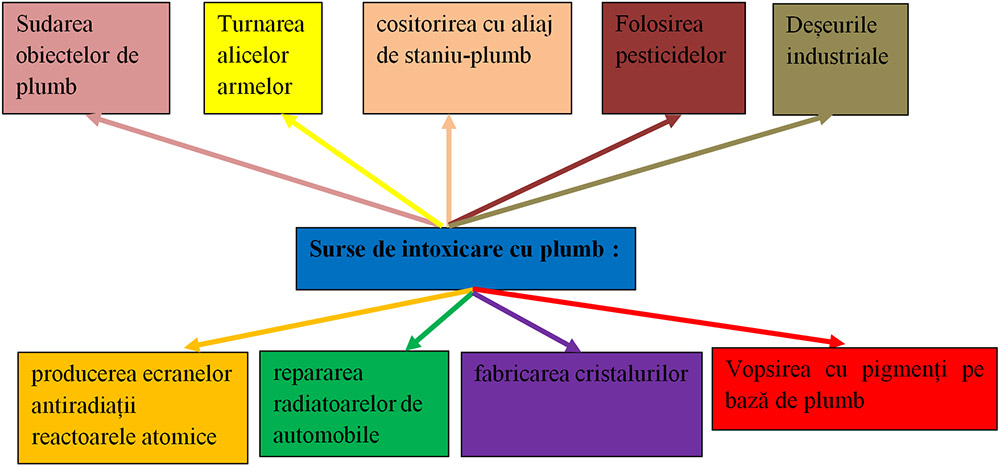
Plumbul şi compuşii acestuia sunt introduși în corp prin ingestie sau inhalare, pot fi absorbiţi prin contactul cu pielea. Fiind foarte asemănător din punct de vedere chimic cu calciul, odată intrat în organism, este „confundat” de acesta cu calciul. Se acumulează, în special, în ţesuturile organismului unde calciul joacă un rol important, cum ar fi dinţii, oasele, etc.
Atenție
Intoxicația cu plumb (saturnismul) poate determina afectare permanentă neurologică şi cognitivă a copiilor. Ȋn cazul adulților, expunerea la plumb indică afecțiuni cronice, cardio-vasculare sau renale. Expunerea ȋn cazul femeilor gravide interferă cu dezvoltarea normală a sarcinii.
Toxicitatea mercurului afectează sănătatea oamenilor. Din cauza toxicității sale, în Europa mercurul este în curs de a fi eliminat din produse.

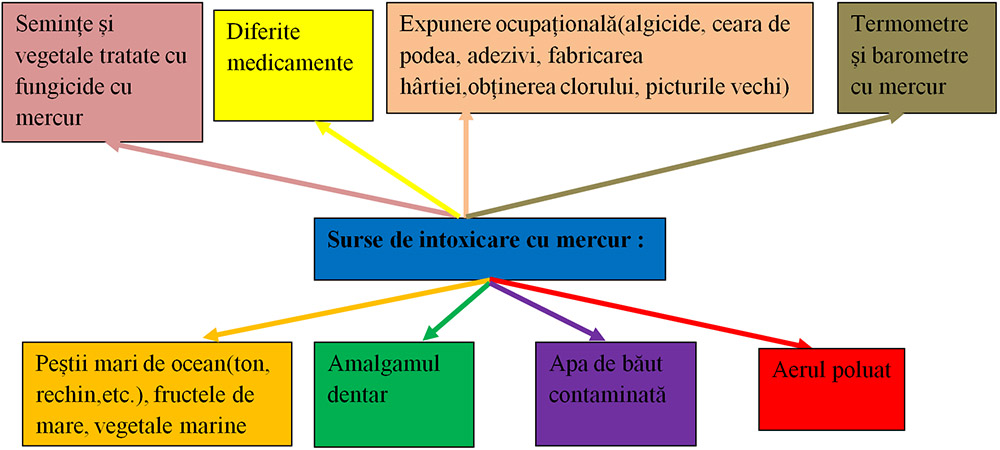
Calea de intrare a mercurului sau compușilor acestuia poate fi cutanată, digestivă sau inhalatorie, cea din urmă fiind forma frecventă de expunere în mediul industrial.
Atenție
Simptomele intoxicatiei cu mercur :
iritații cutanate și inflamație la nivelul pielii
problemele de memorie sau chiar de gândire
tremurul, problemele de coordonare, probleme cu menținerea echilibrului, slăbiciunea musculară
din cauza acumularii mercurului la nivel pulmonar pot aparea probleme de respirație serioase
inhalarea vaporilor de mercur, poate afecta creierul și sistemul nervos, cauzând probleme neurologice precum: dureri de cap, pierderea vederii.
Observație importantă
Există și metale ușoare care în anumite circumstanțe pot deveni toxice, unele fiind esențiale, cum sunt: fierul, seleniul, cuprul, cromul, zincul. Mai sunt metale folosite terapeutic în medicină: aluminiul, bismutul, aurul, galiul, litiul și argintul. Oricare dintre aceste elemente pot avea efecte negative dacă sunt administrate în cantități mari sau dacă mecanismele de eliminare ale corpului sunt limitate.
Unele metale grele sunt esenţiale în diferite procese biochimice (exemplu : Zn, Cu, Cr, Fe, Mn și sunt necesare în cantităţi mici pentru organism, dar care devin toxice pentru organism în cantităţi mari.
De exemplu, zincul este un oligoelement esenţial, component al mai multor sisteme enzimatice. Deficitul de zinc determină lipsa poftei de mâncare, tulburări de creştere, căderea părului, întârzierea procesului de vindecare a rănilor,etc. Expunerea acută la oxid de zinc determină iritaţia tractului respirator, tuse, dureri toracice, greață, etc.
VII.8. Îngrășămintele chimice.
Îngrășămintele chimice sunt substanțe care conțin unul sau mai multe elemente chimice nutritive, în scopul sporirii fertilității solului și al creșterii producției vegetale.
Îngrășămintele chimice pot fi naturale sau artificiale.
Dintre elementele nutritive, azotul, fosforul şi potasiul sunt elemente indispensabile creşterii plantelor. NPK înseamnă azot (N), fosfor (P) și potasiu (K). Azotul este necesar plantelor pentru creștere. Fosforul asigură flori, frunze și fructe sănătoase. Potasiul asigură rădăcini puternice.
Dacă unul din aceste elemente este în cantitate mai mică, planta nu se dezvoltă normal, chiar dacă celelalte două sunt în exces.

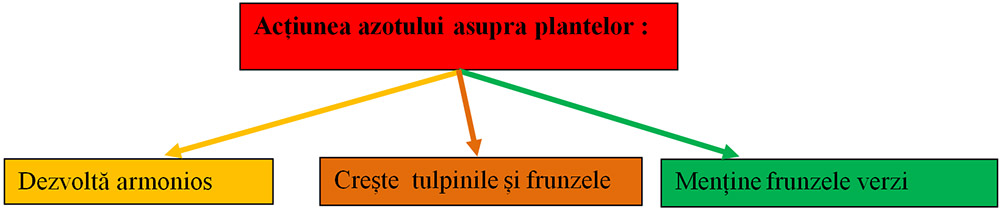
Carența în azot se manifestă mai întâi pe frunzele mature. Acestea se îngălbenesc, începând de la vârf și margini, apoi se veștejesc, se necrozează și în cele din urmă, se usucă. Rădăcinile sunt lungi și cu puține ramificații. Tulpinile sunt scurte și subțiri. Înflorirea este slabă, se scurtează perioada de înflorit. Semințele sau fructele sunt puține și mici, de calitate slabă cu conținut scăzut de proteine, în special la cereale.

Azotul este asigurat plantelor folosind ca îngrășăminte chimice:
- azotatul de amoniu,
- azotatul de sodiu,
- sulfatul de amoniu,
- azotatul de calciu.
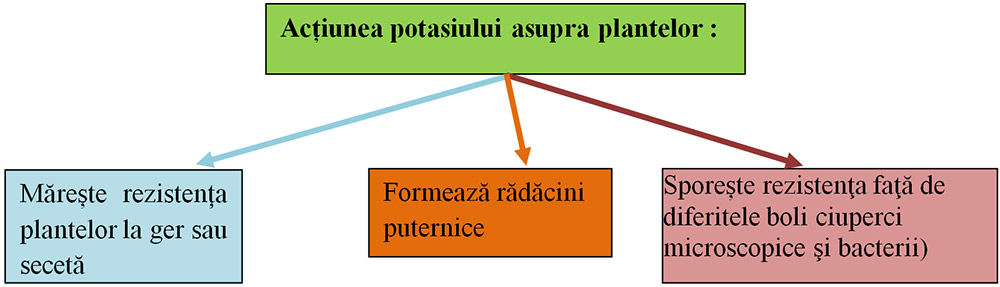
Carența potasiului scade resistența plantelor la secetă, acestea căpătând un aspect de ofilit. Scade rezistența plantelor la cădere și la unele boli. La pomi are loc o înflorire slabă, fructele sunt mici. La vița de vie strugurii sunt puternic atacați de boli, boabele mucegăiesc și putezesc.

Potasiul este asigurat plantelor folosind ca îngrășăminte chimice:
azotatul de potasiu,
clorura de potasiu,
fosfatul diacid de potasiu,
fosfatul monoacid de potasiu.
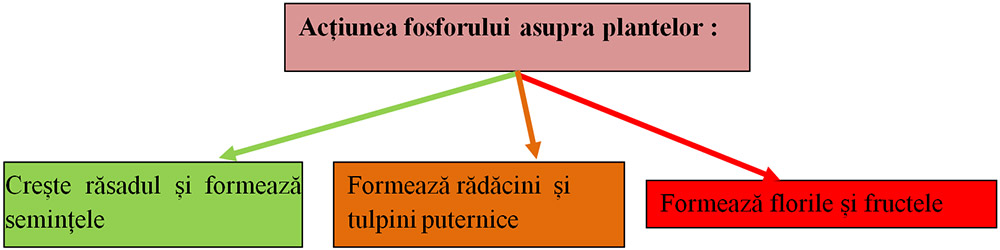
O cultură ce se confruntă cu o lipsă de fosfor va avea o creștere lentă și o vigoare scăzută. Frunzele bătrâne vor avea o culoare verde închis și o pigmentare purpurie.

Fosforul este asigurat plantelor folosind ca îngrășăminte chimice:
- fosfatul de calciu și oxidul de calciu (făina lui Thomas),
- fosfatul monoacid de calciu hidratat (precipitatul).
Atenție
Dacă îngrășămintele chimice sunt utilizate timp îndelungat, iar în unele cazuri în exces, apar o serie de fenomene negative, printre care un conţinut ridicat de azotaţi în plante faţă de nivelul normal. Azotaţii se transformă în azotiți în rădăcinile şi frunzele plantelor. Prin intermediul furajelor, azotații și azotiții ajung şi în organismul animalelor și apoi în alimentaţia omului. Apar, astfel, cazuri de îmbolnăviri la animale şi oameni.
VII.9. Deșeurile.
Deșeurile sunt resturi materiale rezultate dintr-un proces tehnologic (sau casnic) de realizare a unui anumit produs, care nu mai pot fi valorificate direct în realizarea produsului respectiv. Ele pot fi substanțe, materiale, obiecte, resturi de materii prime provenite din activitatile economice, menajere și de consum. Majoritatea activităților umane reprezintă și surse de producere de deșeuri.
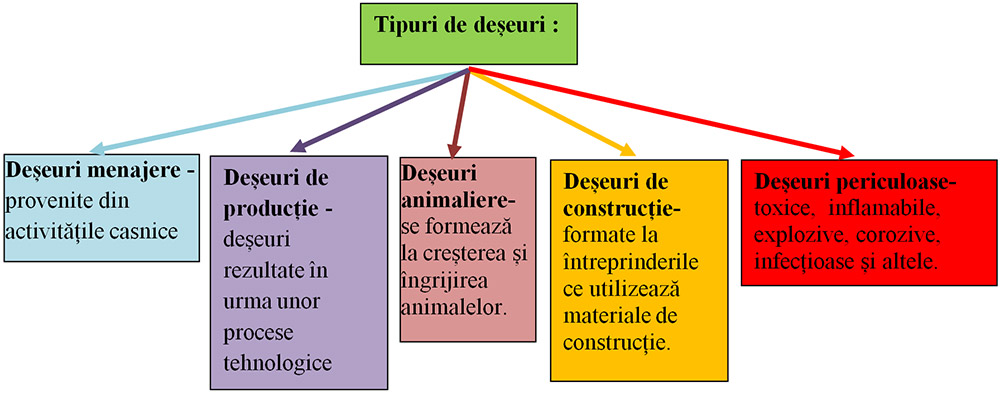
Atenție! Deșeurile periculoase pentru oameni și mediu:
- Bateriile și acumulatorii (de la telefon, de la mașini, laptopuri) conțin metale toxice : mercur, plumb, litiu, cadmiu, nichel, etc.

- Becurile fie ele incandescente, LED sau fluorescente conțin substanțe și gaze toxice care amenință mediul și sănătatea noastră, dintre care principalul este mercurul.

- Medicamentele expirate (antibioticele, antidepresive, preparatele hormonale) aruncate la gunoi pot fi înghițite accidental de către copii și sunt un adevărat pericol asupra mediului înconjurător.

Deocamdată, doar o parte dintre deșeurile periculoase sunt colectate separat si reciclate. Este vorba despre uleiul de motor, bateriile auto, bateriile telefoanelor mobile. Restul, cum ar fi medicamentele, ierbicidele, pesticidele, vopselele, nu sunt deocamdată colectate separat.
Ce pot face eu pentru un mediu sănătos ?
- Limitează utilizarea produselor periculoase, înlocuind o parte din ele cu unele mai puțin dăunătoare. Încearcă alternative ecologice la detergenții obișnuiți. Încearcă să eviți folosirea produselor care au pe etichete următoarele simboluri:

În loc de baterii obișnuite, cumpără baterii reîncarcabile sau acumulatori. Nu arunca la gunoi bateriile, becurile și aparatele electrocasnice uzate. Folosește becurile LED care nu conțin substanțe periculoase și pot fi ușor reciclate. Du-le la centrele specializate (în școli există astfel de centre).
Du înapoi la farmacie medicamentele expirate sau care nu îți mai sunt necesare.
Folosește vopsea pe bază de apă, nu de solvenți.
Cumpară produse doar în cantitatea de care ai nevoie.
Nu arde, nu arunca deșeuri direct pe sol sau în cursurile de apă .
Colectează selectiv deșeurile pe categorii, urmând ca mai apoi să le depui în pubelele amenajate și inscripționate pentru diversele categorii :

- Protejează mediul în care trăiești!

Deșeurile reziduale sunt totalitatea deșeurilor care nu se pot recicla.
Aceste deșeuri se depoziteaza in recipientul gri (sau inscriptionat adecvat), destinat precolectarii deseurilor menajere.

Deșeurile reciclabile se vor depozita în recipientul galben (sau inscriptionat adecvat) / sacul galben.

