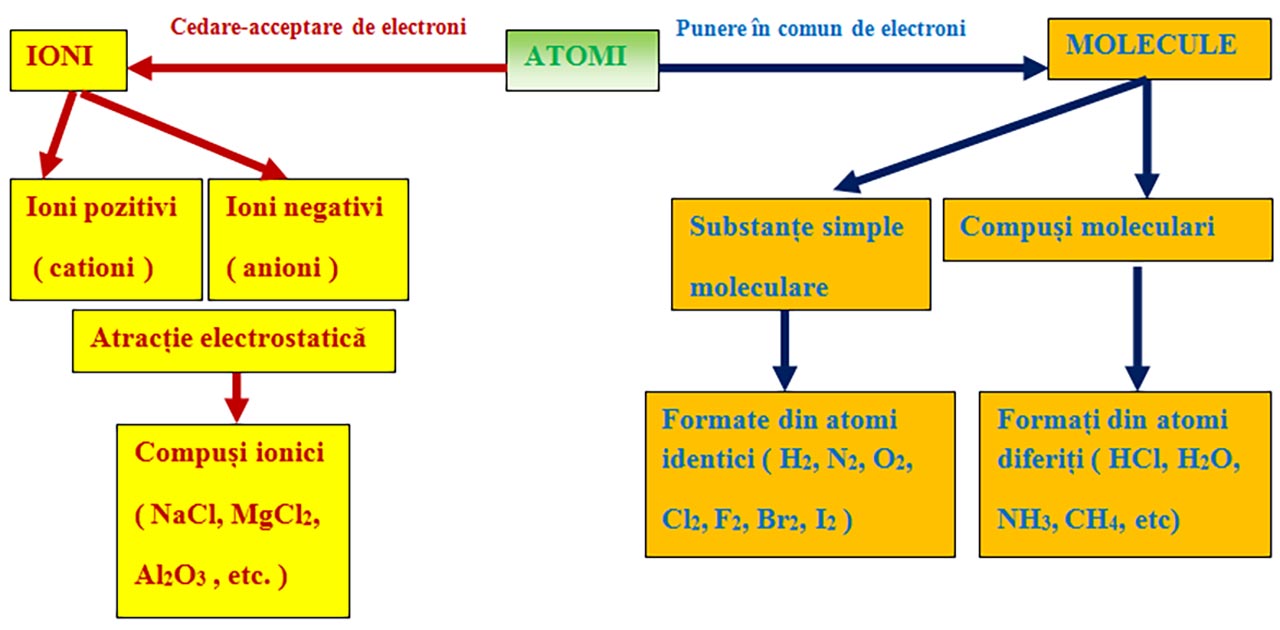
V. IONI ȘI MOLECULE.
5.1. Formarea ionilor
În natură, marea majoritate a substanțelor se găsesc sub formă de compuși chimici.
Elementele chimice care se găsesc sub formă de atomi liberi stabili sunt cele șase gaze nobile ( rare) din grupa a VIII a A( sau grupa nr.18 ) a Tabelului periodic : Heliu(He), Neon(Ne), Argon(Ar), Kripton(Kr), Xenon(Xe) și Radon(Rn), având configurație stabilă a ultimului strat de dublet ( He ) sau octet ( celelalte gaze rare ).
Atomii celorlalte elemente se unesc între ei pentru a obține forme stabile, ioni sau molecule.
Definiție
Proprietatea carcteristică a atomilor de a se uni între ei se numește valență.
Definiție
Electronii periferici (de pe ultimul strat, numit strat de valență) care contribuie la formarea legăturilor dintre atomi se numesc electroni de valență.
Observație
Atomii metalelor, având un număr mic de electroni pe ultimul strat, cedează acești electroni și ajung la configurația stabilă a penultimului strat, identică cu cea a gazului rar precedent lui în Sistemul periodic.
important
Prin cedare de electroni, atomii metalelor devin ioni pozitivi ( cationi ), deoarece vor avea un surplus de protoni în nucleu. Spunem că metalele au un caracter electropozitiv.
Formarea ionilor pozitivi:
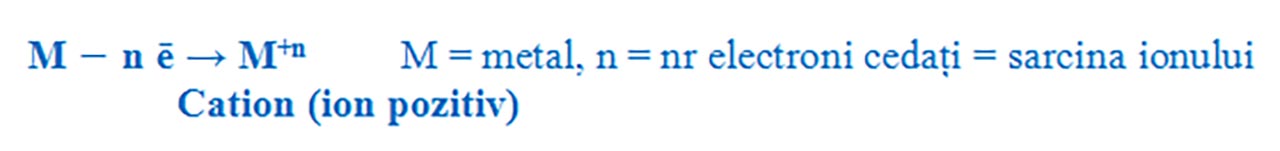
- Metalele din grupa 1 ( I A ) au 1 ē de valență pe care îl cedează, formând ioni pozitivi cu sarcina +1.

- Metalele din grupa a 2 a ( a II-a A ) au 2 ē de valență pe care îi cedează, formând ioni pozitivi cu sarcina +2.

- Metalele din grupa a 13 a ( a III-a A ) au 3 ē de valență pe care îi cedează, formând ioni pozitivi cu sarcina +3.

Observație
Atomii nemetalelor, având un număr mare de electroni pe ultimul strat, acceptă electroni pentru a forma octet stabil pe stratul de valență, identic cu cea a gazului rar ulterior lui în Sistemul periodic.
important
Prin acceptare de electroni, atomii nemetalelor devin ioni negativi ( anioni ), deoarece vor avea un surplus de electroni în înveliș. Spunem că nemetalele au un caracter electronegativ.
Formarea ionilor negativi:
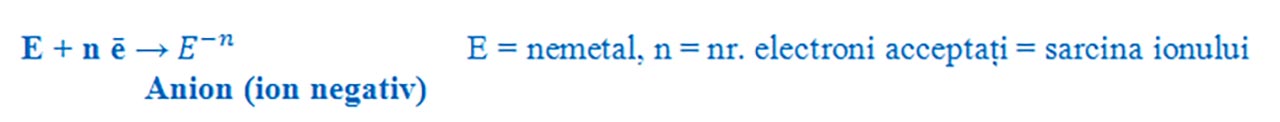
- Nemetalele din grupa a 15 a ( aVA ) au 5 ē de valență și trebuie să accepte 3 ē pentru a ajunge la configurația stabilă de octet, formând ioni negativi cu sarcina - 3.

- Nemetalele din grupa a 16 a ( aVIA ) au 6 ē de valență și trebuie să accepte 2 ē pentru a ajunge la configurația stabilă de octet, formând ioni negativi cu sarcina - 2.

- Nemetalele din grupa a 17 a ( a VIIA ) au 7 ē de valență și trebuie să accepte 1 ē pentru a ajunge la configurația stabilă de octet, formând ioni negativi cu sarcina - 1.

Definiție
Ionii sunt specii (particule) chimice încărcate cu sarcini electrice( deoarece numărul electronilor din înveliș este diferit de numărul protonilor din nucleu) provenite din atomi sau grupe de atomi, prin cedare sau acceptare de unul sau mai mulți electroni.
Nucleul ionului format este identic cu cel al atomului din care provine.
Ionii și atomii care au același număr de electroni se numesc izoelectronici.
Problemă Model
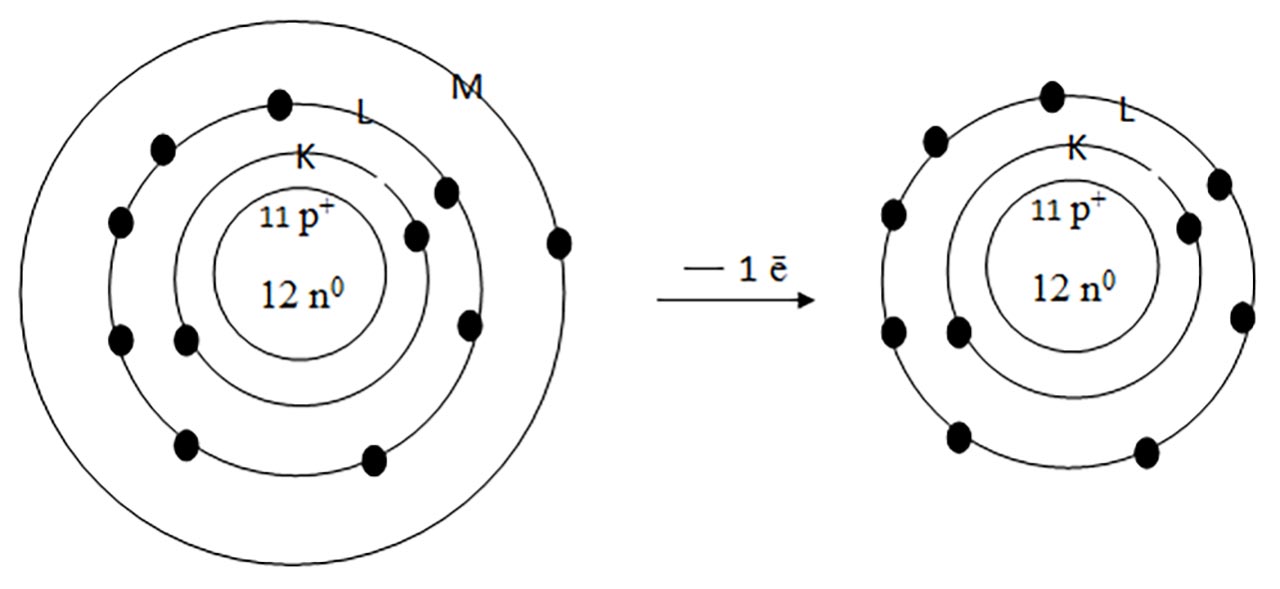
1) Ce atom este izoelectronic (are structură electronică identică ) cu ionul de sodiu?
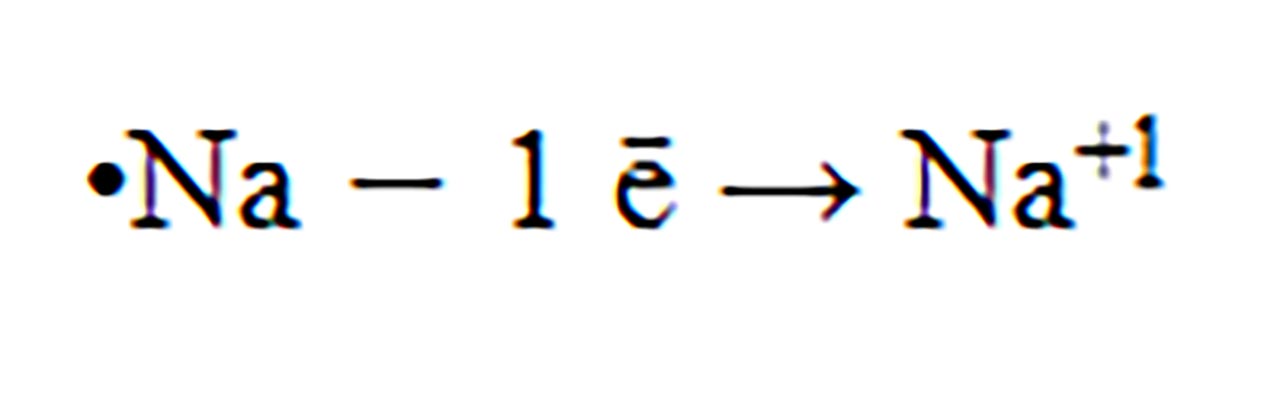
Rezolvare:
Ionul de sodiu, prin cedarea unui electron, rămâne cu 10 ē și va avea octet pe stratul L. Folosind Sistemul periodic observ că gazul rar, Neon are Z = 10 și deci 10 electroni repartizați exact ca ionul de sodiu: pe stratul 1(K) :2 ē și pe 2(L) : 8 ē, deci sunt izoelectronici.
Problemă Model
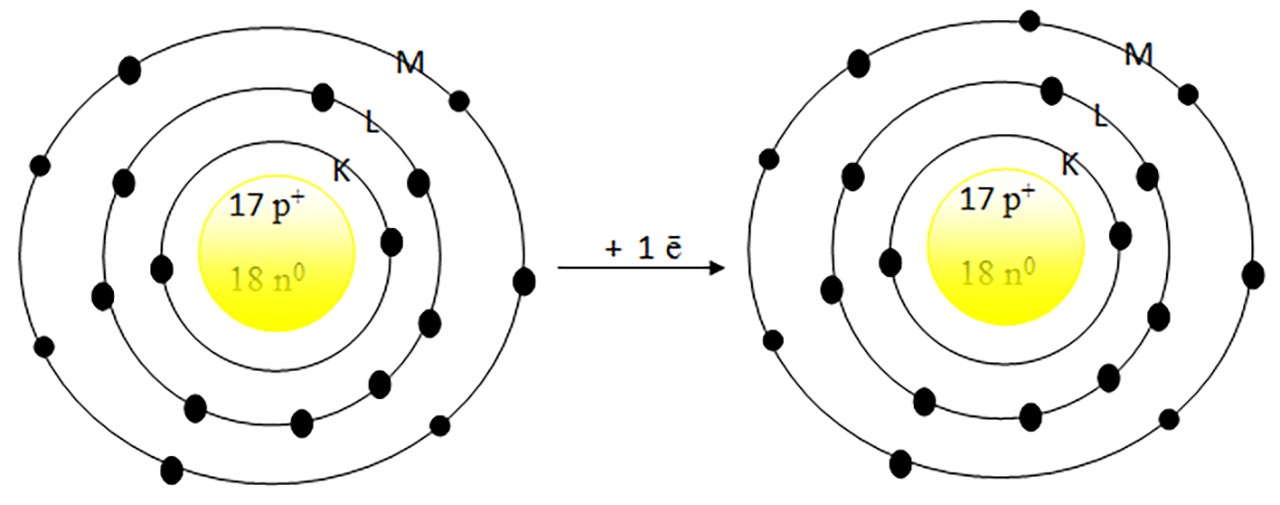
2) Ce atom este izoelectronic cu ionul de clor ?
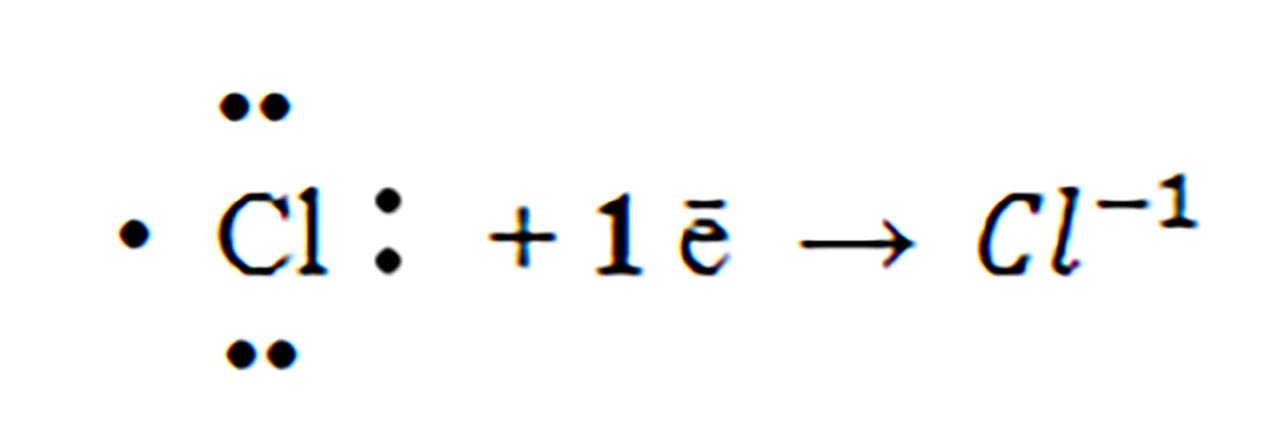
Rezolvare:
Prin acceptarea unui electron, ionul de clor va avea 18 ē . Privind în Sistemul periodic, observ că gazul rar Argon(Ar) are Z =18, cu aceeași configutație electronică cu ionul de clor : 1(K) :2 ē, 2(L):8 ē și 3(L): 8 ē.
Definiție
Valența egală cu numărul electronilor cedați sau acceptați se numește electrovalență.

Denumirea ionilor:
Pozitivi (cationilor) : “ion de (numele metalului)”. Exemplu : ion de magneziu Mg(+2).
Negativi (anionilor) : “ion de (numele nemetalului) +terminația ” ură” . Exemplu : ion clorură Cl(-1). Pentru anionul O(-2) avem denumirea de “oxid de ”
Observație
Când ne referim la caracterul chimic al unui element, spunem ce este, adică metal sau nemetal.
Când ne referim la caracterul electrochimic al unui element, spunem ce fel de ioni formează, pozitivi sau negativi.
Prin urmare:
Metalele au caracter chimic metalic și caracter electrochimic electropozitiv.
Nemetalele au caracter chimic nemetalic și caracter electrochimic electronegativ.
5.2. Compuși ionici
5.2.1. Formarea compușilor ionici
important
Compușii ionici se formează în două etape:
Transfer de electroni ( ē ) de la metale la nemetale cu formarea ionilor pozitivi și negativi.
Atracția electrostatică între ionii de semn opus, fiind legătura chimică (legătură ionică) care se stabilește între ionii de semn contrar. Se formează un compus ionic stabil și neutru din punct de vedere electric (nr. sarcini pozitive = nr sarcini negative), întodeauna între două elemente cu caracter diferit (metale cu nemetale).
Exemple:
a) Sarea de bucătărie: Clorura de sodiu : NaCl
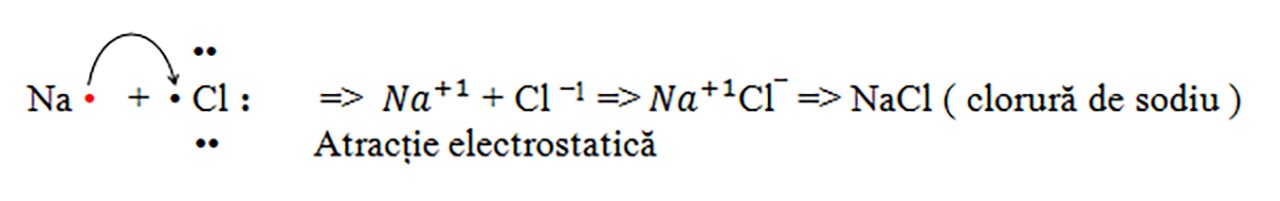
b) Clorura de magneziu : MgCl2
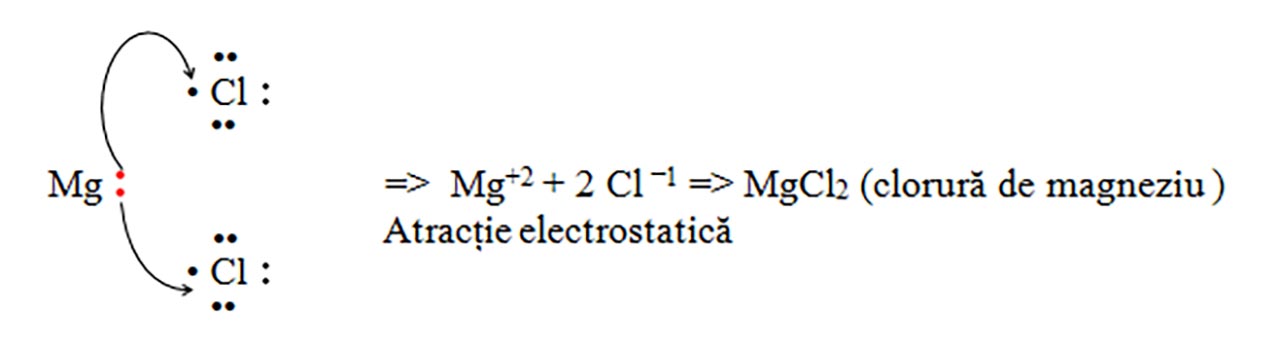
c) Clorura de aluminiu : AlCl3

Experiment
1. Identificarea cationilor
Materiale necesare: mină de grafit și soluții de NaCl, KCl, CaCl2, BaCl2, CuSO4
Atenţie
Atenție să nu te arzi!
Descrierea experimentului:
- Se îmbibă mina de grafit în soluții de NaCl, KCl, CaCl2, BaCl2, CuSO4 și se ține în flacăra unui bec Bunsen(aragaz).
Observaţie
Flacăra se colorează în diferite culori.
Concluzia experimentului:
Prezența unor cationi într-un compus ionic poate fi pusă în evidență prin colorarea diferită a flăcării de către aceștia, astfel:
Na(+1) colorează flacăra în galben-închis
K(+1) colorează flacăra în violet
Ca(+2) colorează flacăra în roșu-deschis
Ba(+2) colorează flacăra în galben-verzui
Cu(+2) colorează flacăra în verde-închis
Cu(+1) colorează flacăra în albastru
Fe colorează flacăra în maroniu
Zn(+2) colorează flacăra în verde-albăstrui
Pb(+2) colorează flacăra în albastru
Problemă Model
3) Modelează formarea compusului ionic dintre potasiu și sulf ?
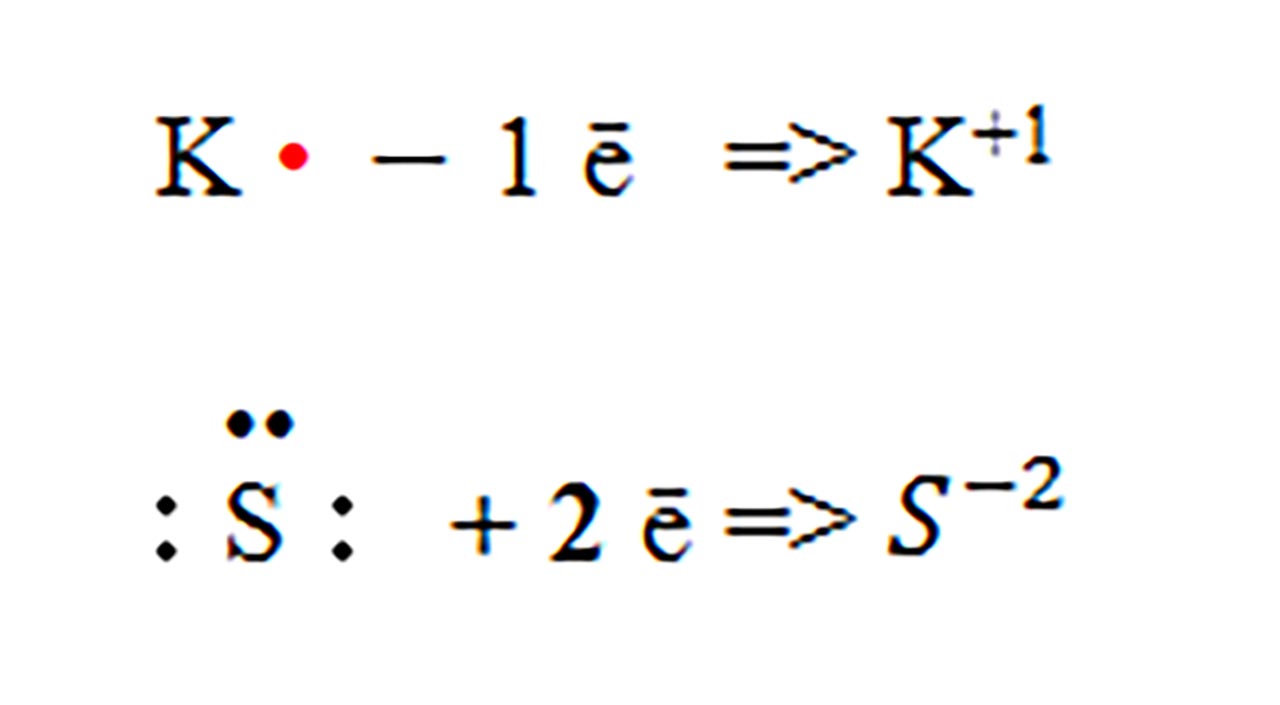
Rezolvare:
Pentru a obține un compus ionic, neutru din punct de vedere electric, trebuie să avem doi atomi de potasiu care să cedeze împreună doi electroni atomului de sulf.

5.2.2. Proprietățile fizice ale compușilor ionici
Experiment
2. Proprietățile fizice ale compușilor ionici
Materiale necesare: 4 pahare Berzelius cu apă,baghetă, spatulă, circuit electric cu baterie, fire și bec, NaCl, CuSO4, K2Cr2O7, BaCl2.
Descrierea experimentului (Partea 1):
- Analizați substanțele din cele 4 probe și stabiliți asemănările și deosebirile dintre proprietățile lor fizice observabile.
Observaţie (Partea 1)
Substanțele ionice sunt solide, divers colorate și cristaline (forme de poliedru).
Cristale cubice de sare ( NaCl ) privite sub microscop.

Descrierea experimentului (Partea 2):
- Verifică conductibilitatea electrică a substanțelor ionice, atât în stare solidă, cât și dizolvate în apă sub formă de soluții.
Observaţie (Partea 2)
În stare solidă, compușii ionici nu conduc curentul electric.
În soluție și în topitură, compușii ionici conduc curentul electric.
Descrierea experimentului (Partea 3):
- Verifică solubilitatea în apă a celor 4 probe.
Observaţie (Partea 3)
Marea majoritate a compușilor ionici sunt solubili în apă.
important
Proprietățile fizice ale compușilor ionici :
1) Substanțele ionice sunt solide, divers colorate și cristaline.
2) Marea majoritate a compușilor ionici sunt solubili în apă.
3) În stare solidă, compușii ionici nu conduc curentul electric.
4) În soluție și în topitură, compușii ionici conduc curentul electric.
5.3. Molecule
5.3.1. Formarea moleculelor
Definiție
Atomii cu același caracter chimic (nemetalele) pot ajunge la configurația stabilă de dublet sau octet punând în comun electronii de valență și formând molecule.
Definiție
În molecule legătura obținută prin punerea în comun de electroni se numește legătură covalentă.
Definiție
Molecula reprezintă cea mai mică particulă dintr-o substanță, care poate exista și în stare liberă și care, păstrează proprietățile substanței din care provine.
important
Caracteristicile moleculelor:
Particule stabile
Particule electric neutre
Au forme și dimensiuni diferite
Între molecule există spații intermoleculare
Moleculele se mișcă dezordonat în funcție de temperatură
Moleculele aceleiași substanțe sunt identice
Reprezintă grupări de atomi identici sau diferiți.
Observație
I. După tipul atomilor care participă la formarea legăturii, aceasta poate fi:
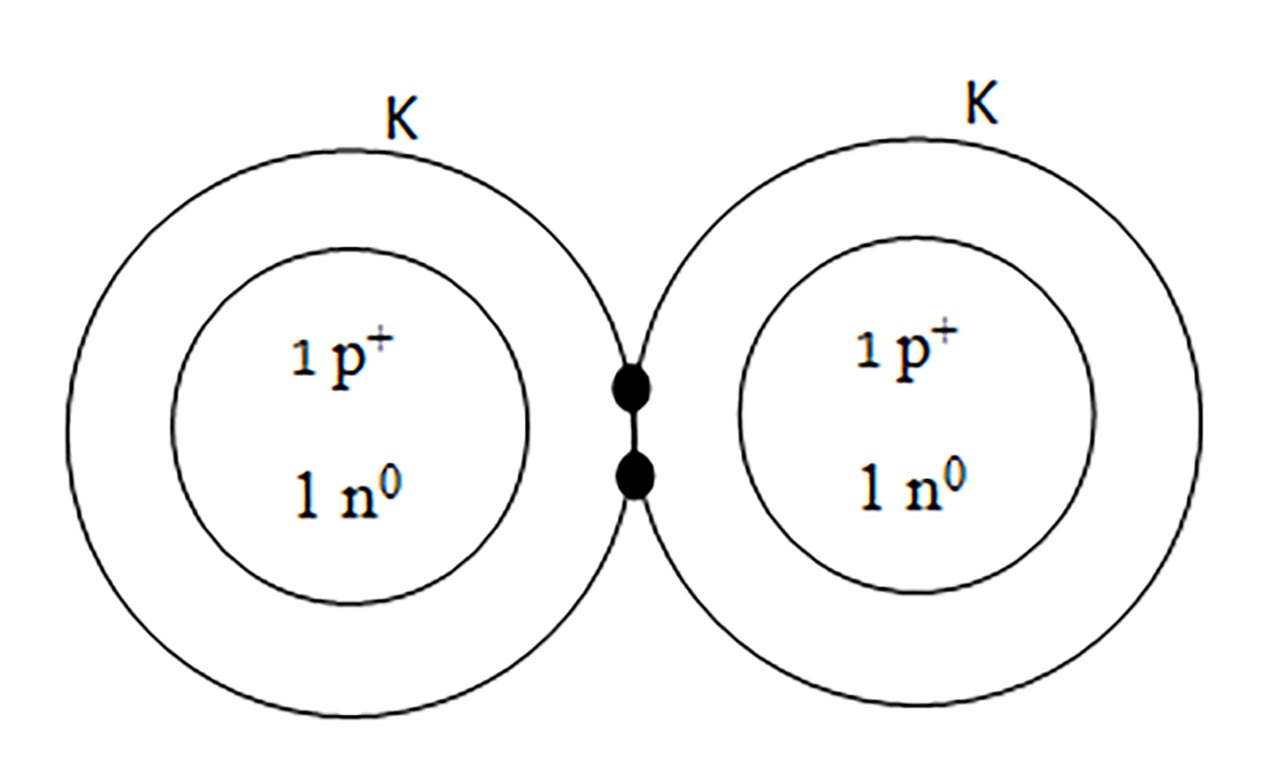
1) Legatură covalentă nepolară prin punerea în comun de electroni între atomi identici. Se formează substanțe simple moleculare ( H2, N2, O2, F2, Cl2, Br2, I2 )
Exemple:
- a) formarea moleculei de hidrogen ( H2 ) :
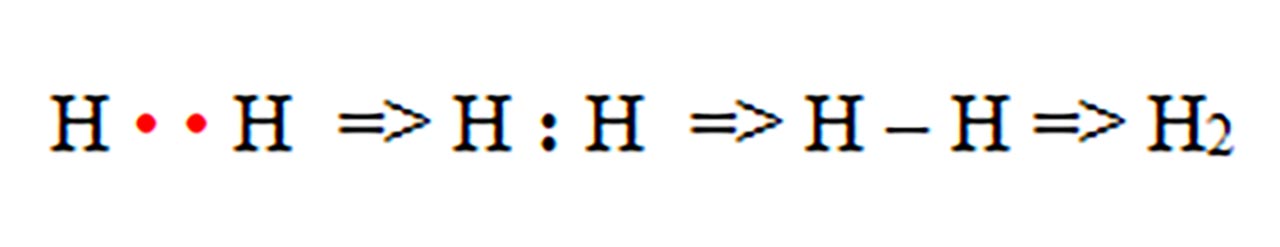
- b) formarea moleculei de clor ( Cl2 ) :
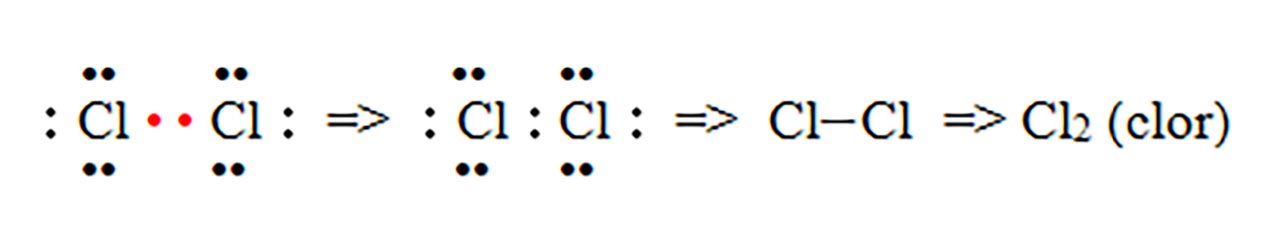
În mod identic se formează și moleculele de F2 (fluor), I2 (iod) și Br2 (brom).
- c) formarea moleculei de oxigen ( O2 ) :
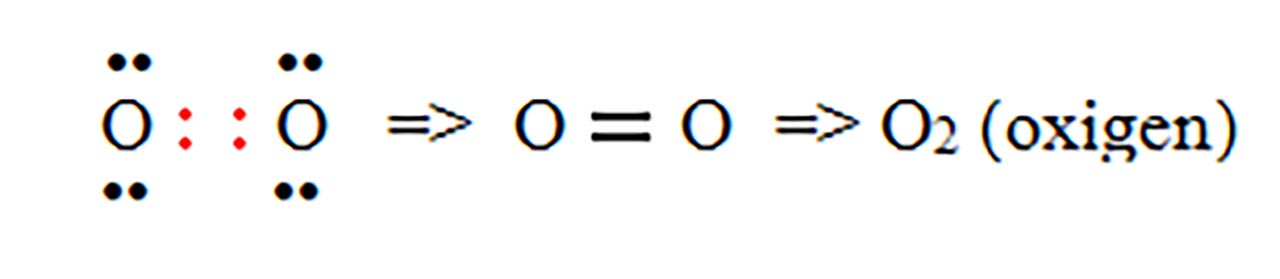
- d) formarea moleculei de azot ( N2 ) :
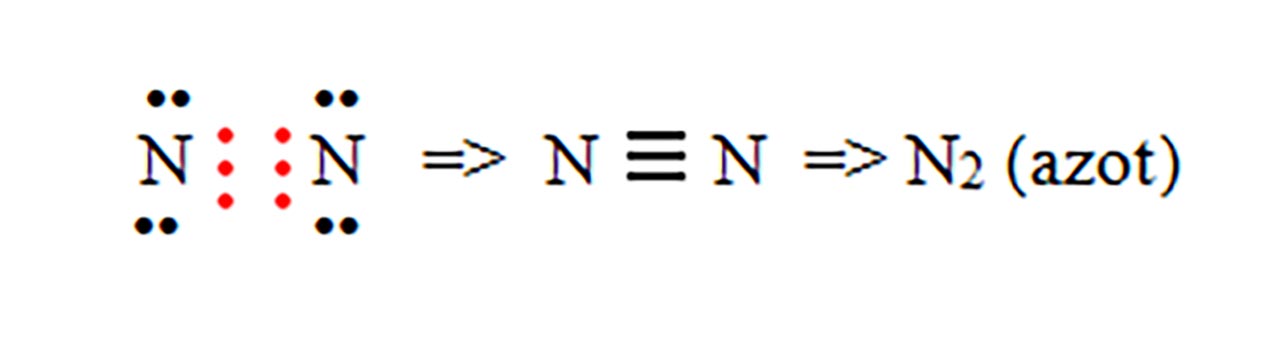
2) Legatură covalentă polară prin punerea în comun de electroni între atomi diferiti.
Exemple:
- a) formarea moleculei de acid clorhidric (HCl)
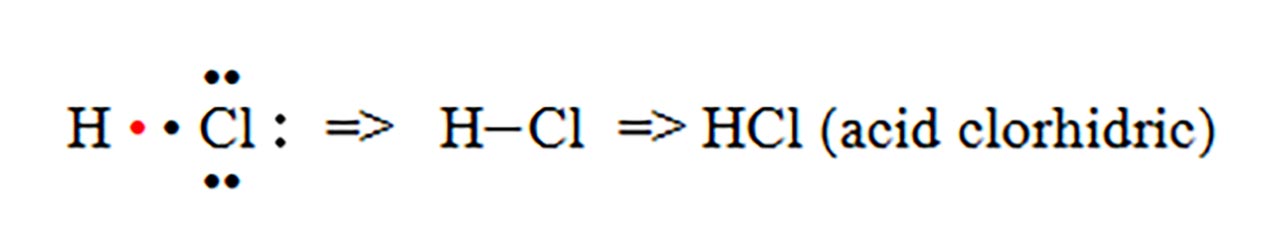
- b) formarea moleculei de apă (H2O)
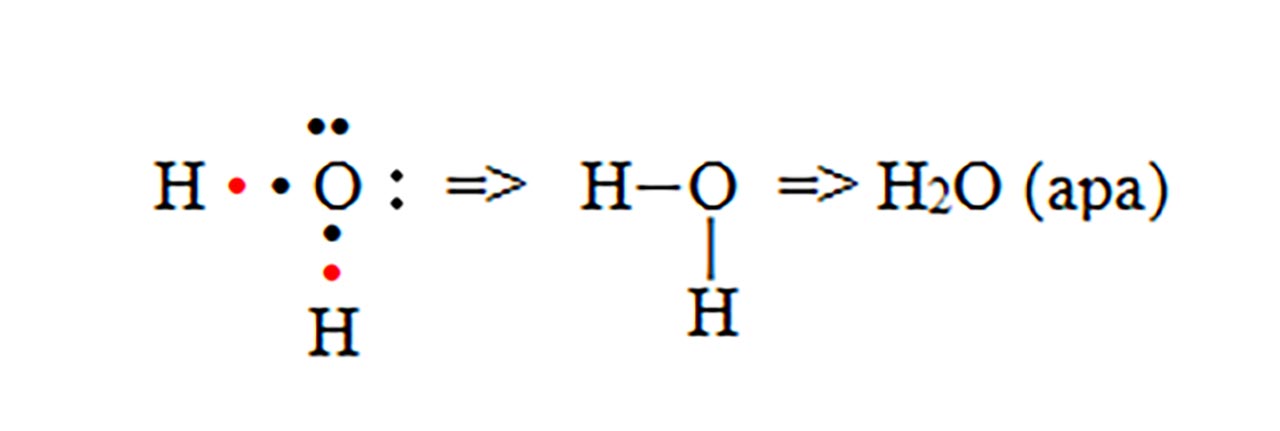
- c) formarea moleculei de amoniac (NH3)
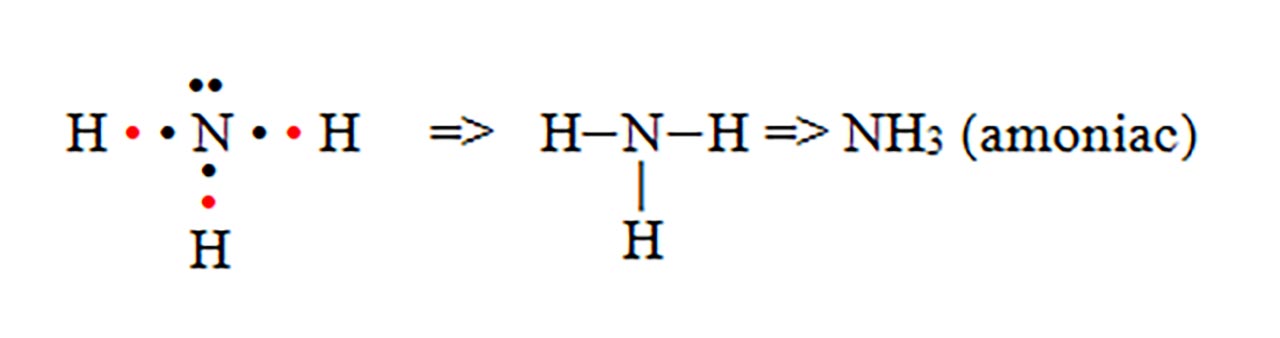
- d) formarea moleculei de metan (CH4)
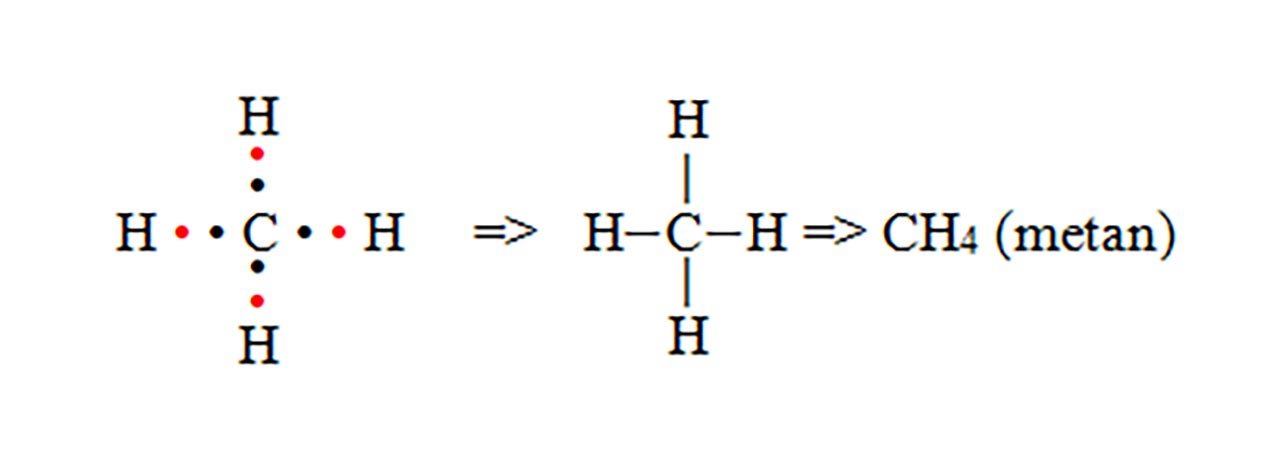
Observație
II.După numărul perechilor de ē puse în comun avem:

Definiție
Formula chimică reprezintă notarea moleculei cu ajutorul simbolurilor chimice ale elementelor componente și al indicelor, pentru a arăta numărul atomilor din fiecare element.
Indicele 1 nu se trece.
Molecula fiind formată din atomi, are dimensiuni foarte mici și masă foarte mică.
Definiție
Masa moleculară este o mărime adimensională (un număr ) care ne arată de câte ori este mai mare masa reală a unei molecule decât unitatea atomică de masă ( u.a.m.).
Ea se calculează ȋnsumând masele atomice relative ale tuturor atomilor moleculei.
Exemplu:
Masa moleculară a apei (H2O) este MH2O= 2 AH +1 AO = 2 + 16 = 18
5.3.2. Proprietățile fizice ale compușilor moleculari
Experiment
3. Proprietățile fizice ale compușilor moleculari
Materiale necesare: 4 pahare Berzelius cu apă,baghetă, spatulă, circuit electric cu baterie, fire și bec, H2SO4, Alcool etilic, acid citric, zahăr, naftalină, mase plastice, apă.
Descrierea experimentului (Partea 1):
- Analizați substanțele din cele 6 probe și stabiliți asemănările și deosebirile dintre proprietățile lor fizice observabile.
Observaţie (Partea 1)
Substanțele moleculare pot fi sunt solide ( zahăr, acid citric, naftalină), lichide (apa, acid sulfuric, alcool etilic) și gazoase ( monoxid de carbon, dioxid de carbon, dioxid de sulf, acid clorhidric, amoniac )
Descrierea experimentului (Partea 2):
- Verifică conductibilitatea electrică a substanțelor moleculare dizolvate în apă sub formă de soluții.
Observaţie (Partea 2)
În soluție unii compuși moleculari conduc curentul electric ( acid sulfuric, acid citric, etc.).
Alți compuși moleculari nu conduc curentul electric, fiind izolatoare electrice ( zahărul, naftalina, masele plastice, etc.).
Descrierea experimentului (Partea 3):
- Verifică solubilitatea în apă a compușilor moleculari.
Observaţie (Partea 3)
Unii compuși moleculari sunt solubili în apă ( zahăr, acid citric, acid sulfuric, monoxidul de carbon, etc.).
important
Proprietățile fizice ale compușilor moleculari:
1) Compușii moleculari se găsesc în toate cele 3 stări de agregare :
Solidă : zahăr, acid citric, mase plastice (macromolecule), naftalină, etc.
Lichidă : apă, apă oxigenată, alcool etilic, acid sulfuric, etc.
Gazoasă : acid clorhidric, dioxid de carbon(CO2), monoxid de carbon (CO), amoniac(NH3), etc.
2) Compușii moleculari , după solubilitatea în apă, sunt:
Solubili (ex. Zahăr, acid citric, HCl, acid sulfuric, amoniac)
Puțin solubili ( ex. CO, CO2)
Insolubili ( mase plastice, metan-CH4) . Aceștia sunt solubili în solvenți organici (acetonă, benzină, benzen, cloroform, tetraclorură de carbon, etc.)
3) Unele soluții ale substanțelor moleculare conduc curentul electric ( acidul clorhidric, acidul sulfuric, acidul citric, etc) , altele nu îl conduc (zahărul, naftalina).
5.4. Valența
Definiție
Proprietatea carcteristică a atomilor de a se uni între ei se numește valență.
important
Valența unui element într-un compus este egală cu numărul electronilor cedați sau acceptați sau puși în comun de un atom al elementului.
Un element chimic poate fi monovalent ( are valența I ), divalent ( are valența II ), trivalent ( valența III), tetravalent ( valența IV ), pentavalent ( valența V ), hexavalent ( valența VI ) sau heptavalent ( valența VII ).
Gazele rare sunt zerovalente, adică nu au valență, deoarece ele deja au structură stabilă de dublet sau octet pe ultimul strat și nu formează compuși chimici.
Observaţie
Valențele elementelor sunt importante pentru a scrie formula unui compus chimic.
Numărul electronilor de pe ultimul strat determină valența elementului.
important
Valențele elementelor chimice situate în grupe principale :
Elementele din primele trei grupe principale I A ( 1 ), IIa A ( 2 ) și III A( 13) au valența egală cu cifra unităților din numărul grupei ( egală cu numărul electronilor de pe ultimul strat ).
Elementele din grupele principale IV A ( 14 ), V A ( 15) , VI A( 16) și VII A (17) au valența egală cu diferența dintre opt și cifra unităților din numărul grupei ( egală cu opt minus numărul electronilor de pe ultimul strat ) în compușii cu hidrogenul sau cu metalele.
Valența nemetalelor variază în compușii cu oxigenul. Același element poate avea mai multe valențe , dar maximă cu numărul grupei.
Deoarece oxigenul este constant divalent, valența nemetalelor se stabilește față de acesta astfel :
În monoxidul de carbon (CO) : O –valența II și C-valența II (divalent) , deoarece se combină cu 1 atom de O.
În dioxidul de carbon (CO2 ) : O –valența II și C-valența IV (tetravalent) , deoarece se combină cu 2 atomi de O.
În trioxidul de sulf ( SO3 ) : O –valența II și S-valența VI (sexavalent) , deoarece se combină cu 3 atomi de O.
Observaţie
Pentru elementele din grupele secundare ( metalele tranziționale ) nu putem afla valența lor după numărul grupei , deoarece ele nu au întotdeauna numărul electronilor de pe ultimul strat egal cu cifra unităților din numărul grupei.
Fierul poate fi divalent sau trivalent, cuprul poate fi monovalent sau divalent.
Problemă Model
4) Se dau următoarele elemente chimice : Na ( Z = 11 ), Al ( Z = 13 ), O (Z =8) și F ( Z = 9 ). Modelează compușii ionici care îi pot forma aceste elemente chimice și determină valențele lor.
Rezolvare:
Întâi aflăm grupele principale ( nr. electronilor de valență) ale celor patru elemente scriind configurația electronică a acestora :
Na ( Z = 11 ) : 1(K) :2 ē, 2(L) : 8 ē, 3 (M) : 1 ē , deci are un electron de valență, fiind în grupa I A.
Al ( Z = 13 ) : 1(K) :2 ē, 2(L) : 8 ē, 3 (M) : 3 ē , deci are trei electroni de valență, fiind în grupa III A.
O (Z = 8) : 1(K) :2 ē, 2(L) : 6 ē , deci are șase electroni de valență, fiind în grupa VIA.
F (Z = 9) : 1(K) :2 ē, 2(L) : 7 ē , deci are șapte electroni de valență, fiind în grupa VIIA.
- În funcție de numărul electronilor de valență, scriem procesul de ionizare al acestor atomi. Cei care au un număr mic de electroni pe ultimul strat ( maxim trei ), vor ceda acești electroni, rămânând cu configurația stabilă a penultimului strat.
Atomii care au un număr mare de electroni de valență, vor accepta electroni pentru a avea octet pe ultimul strat ( 8 – nr. grupă).
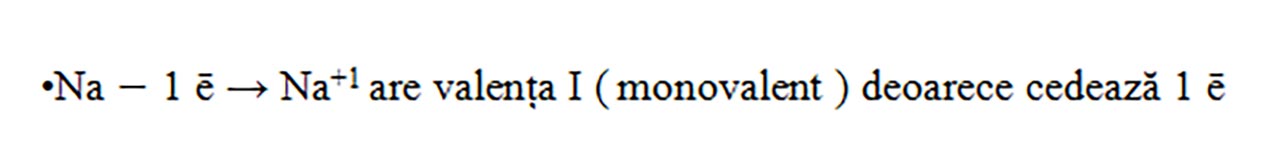
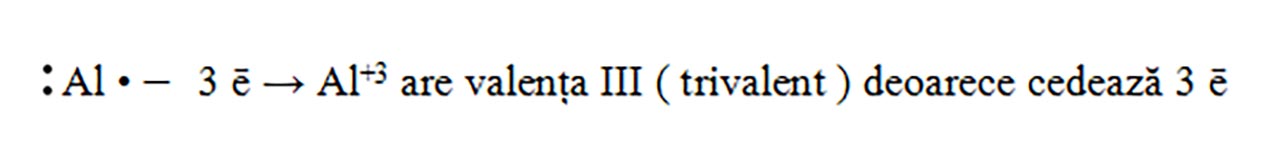
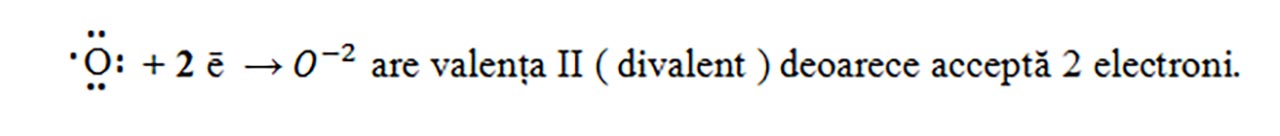
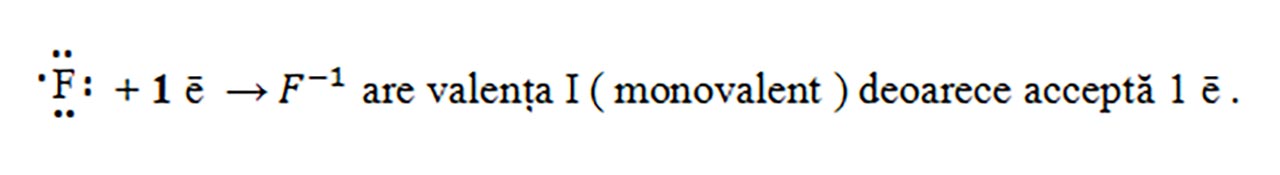
- Modelăm formarea compușilor ionici astfel încât numărul sarcinilor pozitive să fie egal cu numărul sarcinilor negative :
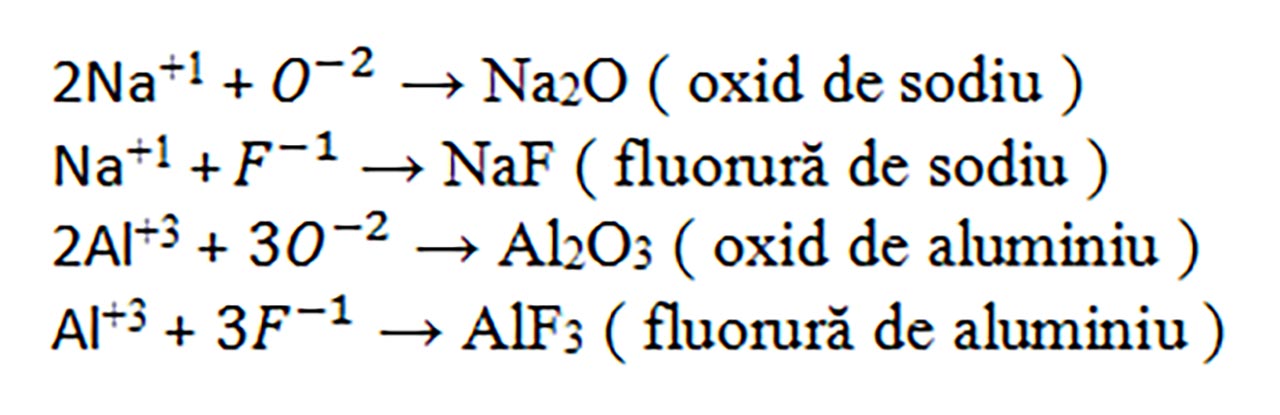
Problemă Model
5) Modelează formarea moleculei dintre hidrogen, H ( Z = 1 ) și sulf, S ( Z = 16 ).
Rezolvare:
Întâi aflăm numărul electronilor de valență ale celor două elemente scriind configurația electronică a acestora :
H ( Z = 1) : 1(K) :1 ē, deci are un electron de valență.
S( Z = 16 ) : 1(K) :2 ē, 2(L) : 8 ē, 3 (M) : 6 ē , deci are șase electroni de valență.
Știind electronii de valență ai celor doi atomi, obser€văm că doi atomi de H trebuie să pună fiecare în comun câte un electron, astfel încât sulful să ajungă la octet și hidrogenul la dublet.
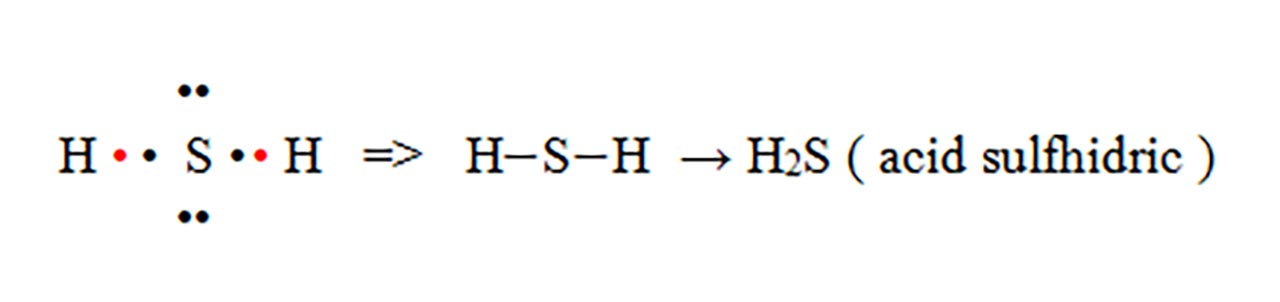
H este monovalent ( are valența I ) deoarece pune în comun un electron.
S este divalent ( are valența II ) deoarece pune în comun doi electroni.