IV. TABELUL PERIODIC AL ELEMENTELOR
4.1. Structura tabelului periodic
Chimistul rus, Dimitri Mendeleev, a publicat în anul 1869 ceea ce avea să fie primul tabel periodic recunoscut la nivel mondial.

A scris pe cartonașe elementele chimice cunoscute atunci ( în număr de 70) , masa lor atomică și câteva proprietăți importante și le-a aranjat în ordinea creșterii masei lor atomice, punând unele sub altele pe cele cu proprietăți asemănătoare.
Iată cum arăta Tabelul lui Mendeleev:
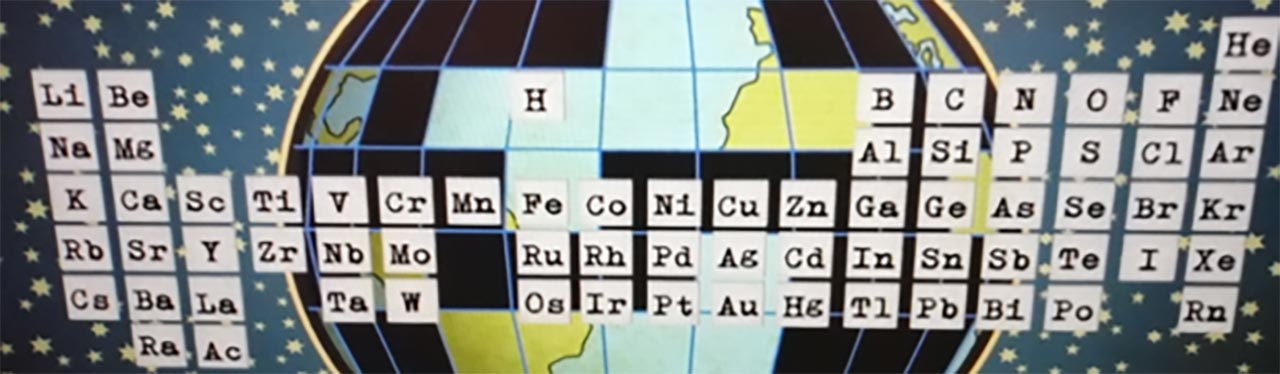
Astfel, a fost realizat Tabelul periodic al elementelor, câteodată numit și Sistemul periodic al lui Mendeleev, care cuprinde într-o formă tabelară toate elementele chimice, aranjate în funcție de numărul lor atomic și unele proprietăți.
Mendeleev a prezis unele proprietăți ale elementelor încă nedescoperite, care păreau să lipsească din tabel. Majoritatea predicțiilor s-au dovedit a fi adevărate pe măsură ce noi elemente au fost descoperite. De atunci, tabelul periodic al lui Mendeleev a fost dezvoltat și corectat, întrucât noi elemente au fost sintetizate sau descoperite.
Toate elementele, de la numărul atomic 1 (hidrogen) până la 118 (oganesson) au fost descoperite în natură sau obținute artificial (sintetizate). Sinteza elementelor cu un număr atomic peste 118 este planificată în viitor.
Mendeleev descoperă legea periodicității.
Definiţie
Legea periodicității:
Proprietățile fizice și chimice ale elementelor se repetă în mod periodic, în funcție de numărul atomic Z.
important
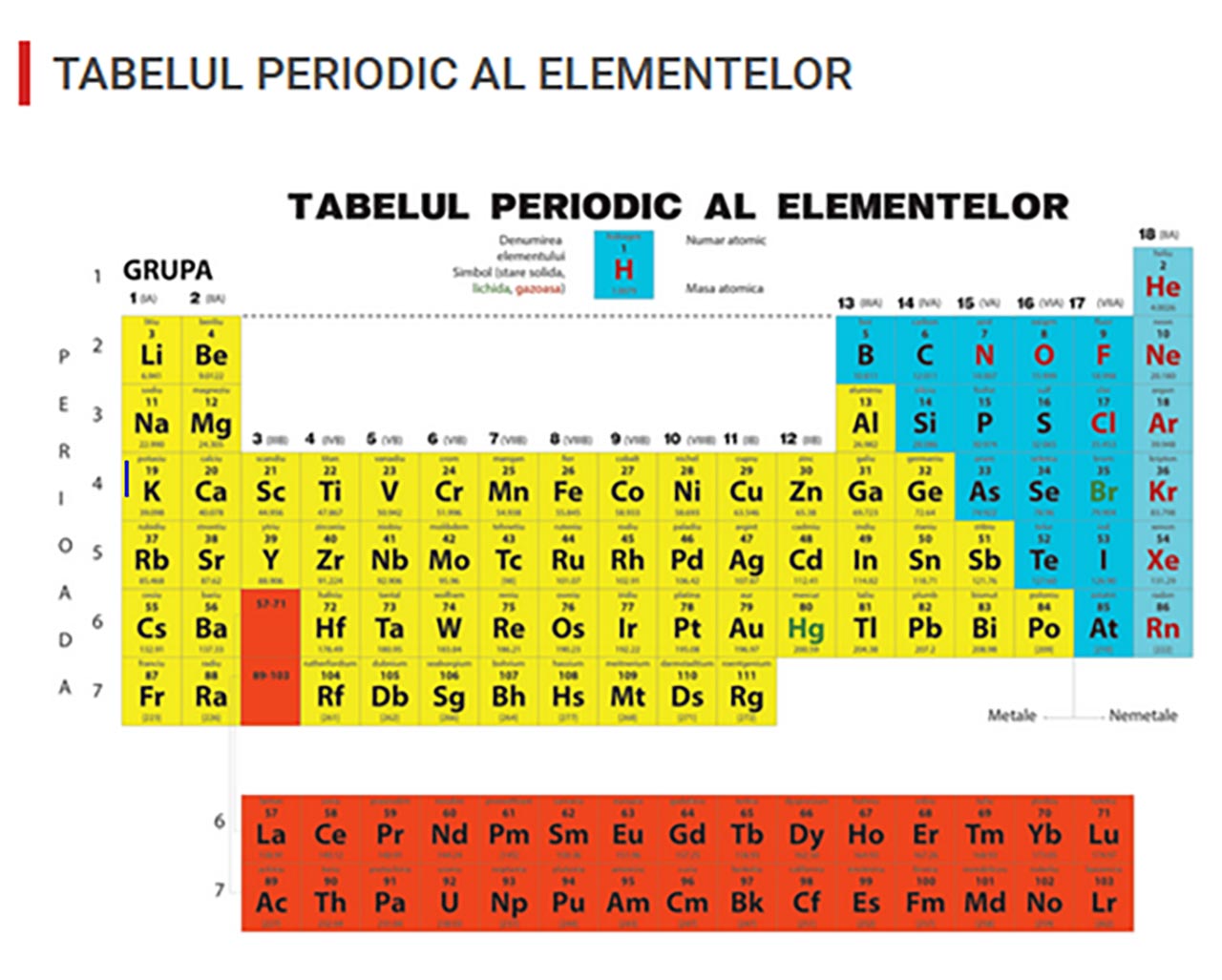
Cele 7 șiruri orizontale din tabel se numesc perioade. Perioadele, notate cu litere arabe de la 1 la 7, sunt șiruri orizontale care conțin 2,8,18 sau 32 de elemente și fiecare perioadă se termină cu un gaz rar.
Coloanele verticale din tabelul periodic, care conțin elemente ale căror atomi conțin același număr de electroni pe ultimul strat și care au proprietăți asemănătoare se numesc grupe.
Grupele sunt în nr de 18 și se clasifică în :
1) Grupe principale notate cu cifre romane urmate de litera A ( ex. IA-VIII A) sau cele cu cifre arabe 1,2,13,14,15,16,17,18 și conțin mai mult de 5 elemente.
2) Grupele secundare notate cu cifre romane urmate de litera B în nr. de 10 (ex. IB-VIIIB, ultima fiind în nr. de 3 grupe) sau cu litere arabe (3-12).
Poziția unui element chimic în Sistemul periodic este dată de perioada și grupa în care este situat.
În tabelul periodic avem trei tipuri de substanțe simple:
Metale alcaline (gr.IA), alcalino-pământoase (IIA), pământoase (IIIA) și metale tranziționale (cele din grupele secundare).
Nemetale separate de metale printr-o linie îngroșată, în zig-zag (scăriță) și aflate deasupra liniei.
- Gaze rare situate în grupa VIII A : He, Ne, Ar, Kr, Xe, Rn.
Temă
Observă Tabelul periodic și răspunde la următoarele întrebări :
1) Care dintre elementele H, Cu, Mg, C, I, Na fac parte din perioada a 3-a?
2) Care este legea după care s-a stabilit poziția elementelor în acest Tabel?
3) Denumește metalele alcaline și nemetalele din grupa a VII A .
4) Care este poziția în Sistemul periodic al următoarelor elemente: H, K, O, Al, F, Cu ?
5) Completează spațiile libere:
a) Savantul rus .............................. aranjează unele sub altele elemente cu .....................................................................
b) Același șir orizontal cuprinde ................................ în ordinea ...................... a ..................................................
c) Tabelul periodic conține un nr. de ........coloane, numite................... și un nr. de........șiruri, numite...............................
4.2. Relația dintre structura atomului și poziția sa în Sistemul periodic.
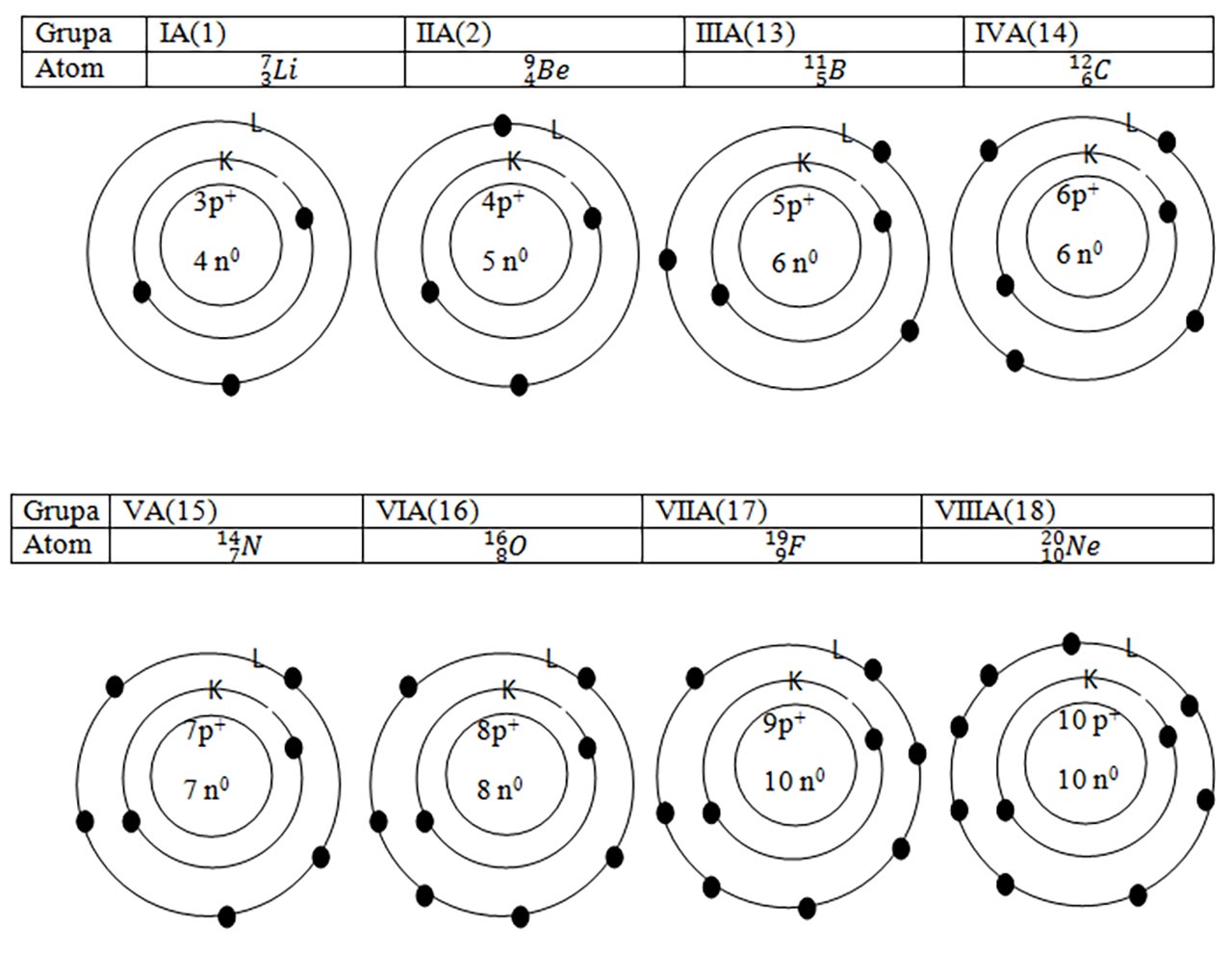
Ce legătură observi între numărul grupei al fiecărui element și numărul de electroni de pe ultimul strat al atomilor respectivi?
Toți cei 8 atomi reprezentați se află în perioada a 2-a. Ce legătură observi între numărul perioadei și numărul de straturi ai fiecărui atom?
important
Numărul electronilor de pe ultimul strat al atomului este egal cu cifra unităților din numărul grupei în care se află elementul.
Numărul perioadei în care se află un element este egal cu numărul stratului în curs de completare (ultimul strat) din structura electronică a atomului acelui element.
Problemă Model
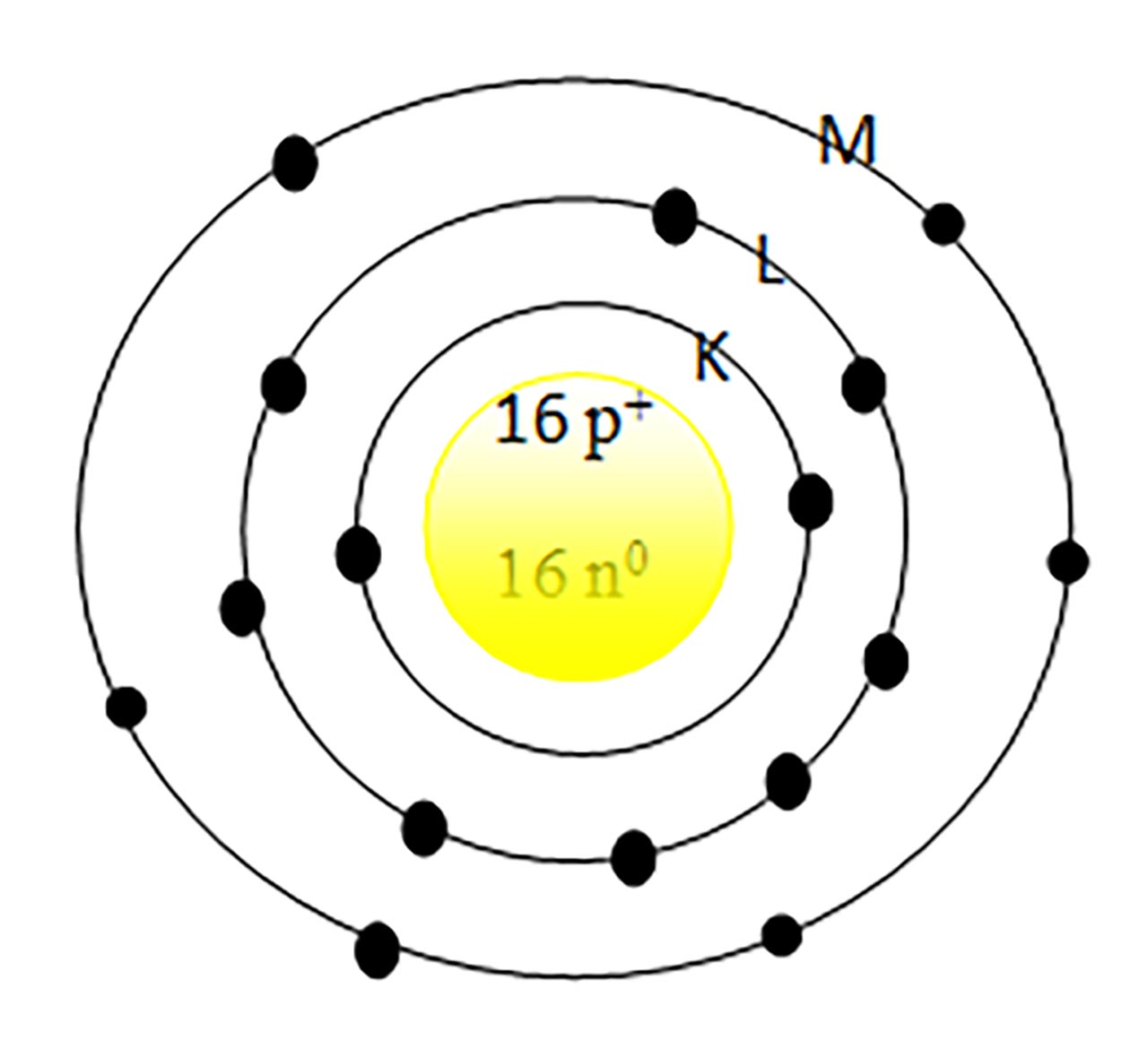
1) Un element are pe stratul 3(M)-6 electroni. Stabilește structura atomului și poziția acestuia în Sistemul periodic.
Desenăm în mijloc nucleul.
Urmează învelișul electronic punând pe stratul 1(K) : 2 ē, 2 (K) : 8 ē și 3(M) : 6 ē.
Numărăm toți electronii = 16, deci Z = 16 = nr. ē = nr. p+ (îi punem în nucleu)
Acest atom având 6 ē pe ultimul strat înseamnă că se află în grupa VIA (16).
Acest atom având 3 straturi înseamnă că se află în perioada a 3-a.
Căutăm în Sistemul periodic și vedem că este vorba de elementul S cu A=32. Calculăm nr. n0 : N = A – Z = 32 – 16 = 16 n0, pe care îi punem în nucleu.
Problemă Model
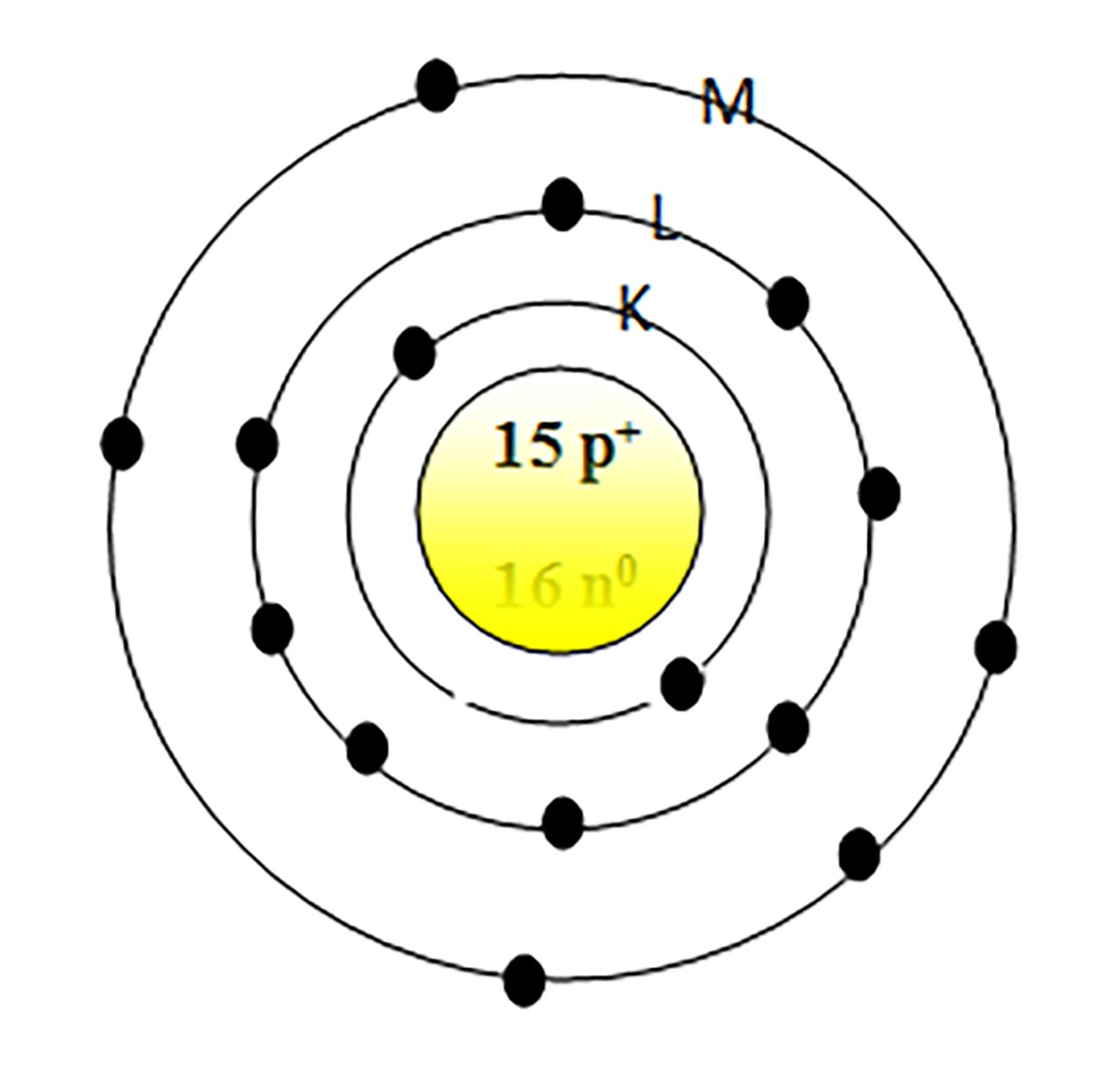
2) Un element are Z = 15 și A = 31. Reprezintă structura atomului și poziția lui în Sistemul periodic.
- Reprezentăm structura atomului.
Z = 17 = nr. ē = nr. p+
N = A – Z = 31 – 15 = 16 n0
Urmează învelișul electronic punând pe stratul 1(K) : 2 ē, 2 (K) : 8 ē și 3(M) : 5 ē.
Nr.grupei = VA(15) = nr. ē pe ultimul strat.
Nr. perioadei = a 3-a = nr. de straturi.
4.3. Metale. Nemetale. Proprietăți.
Metalele se diferențiază de nemetale pe baza unor proprietăți fizice și chimice generale și pe baza structurii electronice a ultimului strat.
Experiment
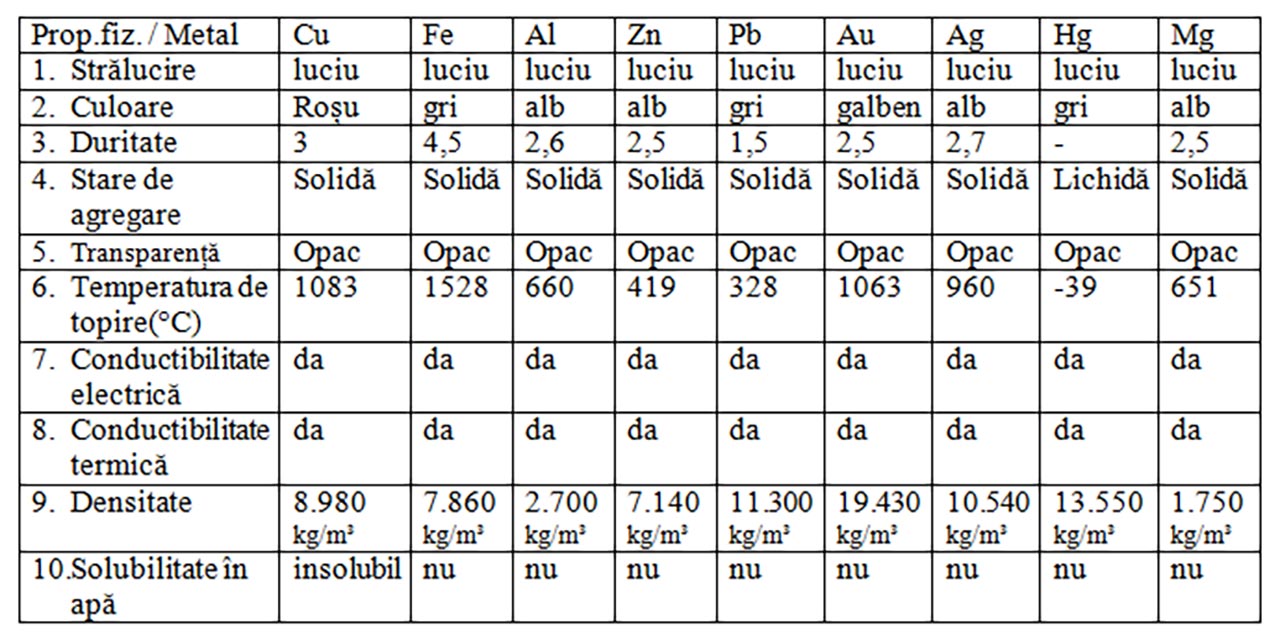
1. Analiza proprietăților fizice ale metalelor
Materiale necesare: clește metalic, pahar Berzelius cu apă, spirtieră, circuit electric cu baterie, fire și bec, obiecte metalice(Cu, Fe, Al, Zn, Pb, Au, Ag, Hg, Mg), lumânare.
warning
Atenție! Mercurul este extrem de toxic ! Nu inhala vaporii săi! Nu îl atinge și nu il gusta!
Descrierea experimentului:
Observă pentru fiecare metal o serie de proprietăți fizice: culoare, stare de agregare, aspect, plasticitate (ușurința cu care se deformează, duritate (rezistența la rupere).
Notează în tabel densitățile metalelor (vezi anexă manual).
Notează în tabel temperaturile lor de topire ( vezi anexă manual).
Verifică conductibilitatea lor electrică cu ajutorul circuitului în care se intercalezi diferitele metale.
Verifică conductibilitatea lor termică, încălzind corpul metalic pe care ai picurat bobițe de ceară, la un capăt în flacăra unei spirtiere.
- Completează tabelul următor
important
Proprietățile generale ale metalelor:
Sunt solide (cu excepția mercurului)
Au luciu metalic
Gri-argintii (cu excepția Cu - arămiu și Au - auriu)
Conductoare termice și electrice
Marea majoritate au temperaturi de topire ridicate
Marea majoritate au densități ridicate
Sunt maleabile (pot fi trase în foi) și ductile (pot fi trase în fire)
Insolubile în apă
Solubile unele în altele în topitură, formând aliaje.
Observaţie
Aliajele sunt amestecuri omogene de metale sau metale cu nemetale, fiind obținute prin amestecarea lor în stare topită.
Cele mai cunoscute aliaje sunt:
fonta (Fe + 1,7-5% C);
oțelul(Fe + 0,3-2% C);
alama (Cu-Zn);
bronzul (Cu-Sn);
aliaj de lipit metale (Pb-Sn);
duraluminiul (Al-Cu-Mg-Mn), etc.
Experiment
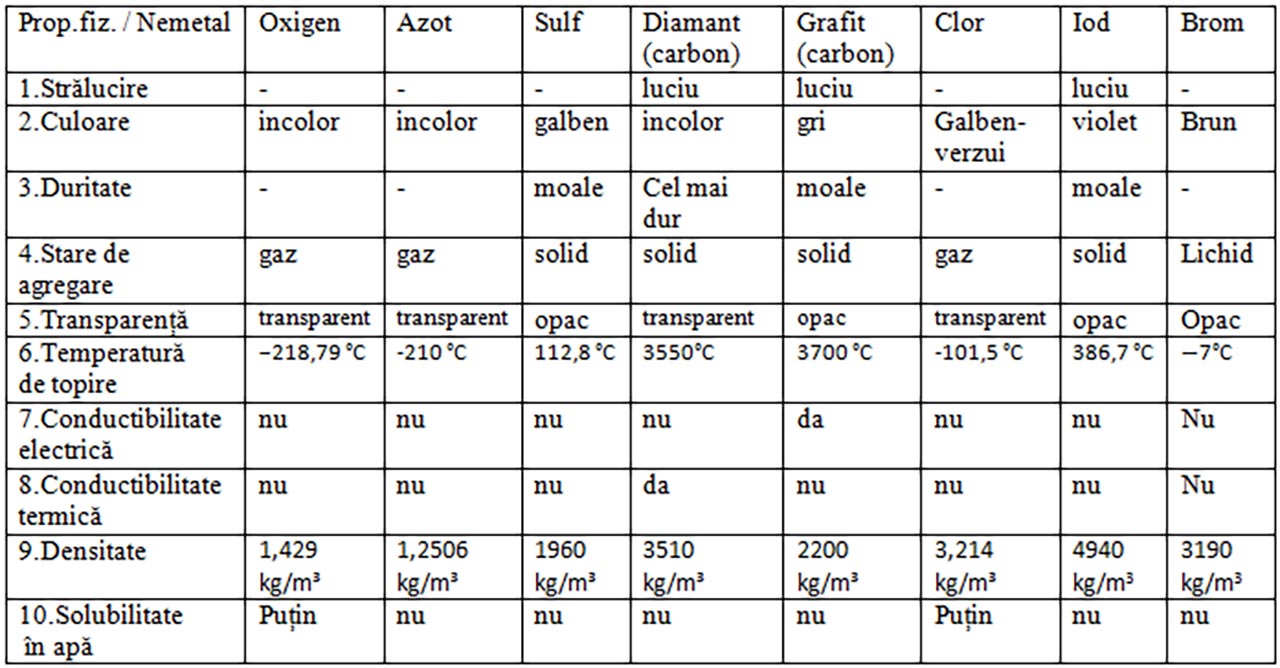
2. Analiza proprietăților fizice ale nemetalelor
Materiale necesare: pahar Berzelius cu apă, circuit electric cu baterie, fire și bec, nemetale: oxigen, azot, sulf, carbon (grafit, diamant), clor, iod, brom.
warning
Atenție! Clorul, bromul şi iodul sunt substanţe toxice şi iritante pentru plămâni ! Nu inhala vaporii lor! Nu le atinge și nu le gusta!
Descrierea experimentului:
Observă pentru fiecare nemetal o serie de proprietăți fizice :culoare, stare de agregare, aspect, plasticitate (ușurința cu care se deformează, duritate(rezistența la rupere).
Notează în tabel temperaturile lor de topire și densitățile lor.
Verifică conductibilitatea lor electrică cu ajutorul circuitului în care se intercalează diferitele nemetale solide.
Completează tabelul următor
important
Proprietățile generale ale nemetalelor:
Sunt solide (iod, carbon, sulf, fosfor, siliciu), lichide(bromul) și gazoase(hidrogen, oxigen, azot, fluor, clor, gazele rare)
Nu au luciu (cu excepția diamantului, grafitului și iodului)
Incolore sau divers colorate
Izolatoare termice (cu excepția diamantului) și electrice (cu excepția grafitului)
Nu sunt maleabile și ductile
Marea majoritate au temperaturi de topire foarte mici (cu excepția diamantului)
Marea majoritate au densități mici
Insolubile în apă (cu excepția oxigenului, azotului și clorului)
Nemetalele solide sunt casante (se sparg)