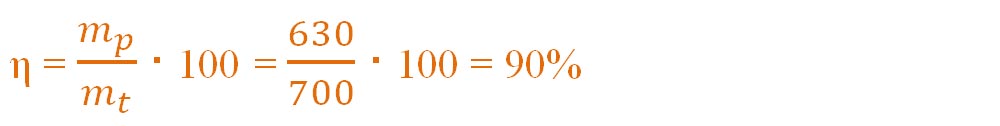V.TIPURI DE REACȚII CHIMICE. REACȚIA DE SUBSTITUȚIE.
V.1. Reacția de substituție (simplă înlocuire). Seria activității chimice a metalelor.
Știind că următoarele două reacții sunt reacții de substituție, descoperă caracteristica comună a celor două reacții:
2Al + 6HCl = 2AlCl3 + 3H2↑
Zn + PbCl2 = ZnCl2 + Pb ↓
Observăm că avem un doi reactanți și doi produși de reacție, dintre care unul este o substanță simplă și celălalt este o substanță compusă. De asemenea, Al a luat locul H din HCl (în prima ecuație) și Zn a luat locul Pb (în a doua ecuație).
Definiţie
Reacția de substituție (simplă înlocuire) este reacția în care un element chimic înlocuiește un alt element chimic din substanța compusă.
important

- Ca reactanți avem o substanță simplă (A) și o substanță compusă (BC).
- Ca produși avem o substanță simplă (B) și o substanță compusă (AC).
- Substanța simplă ia locul primului element din substanță compusă și de aceea se mai numește și reacție de simplă înlocuire.
important
Ca tipuri de reacții de substituție avem reacția dintre un metal și o substanță compusă:
- cu apă;
- cu un oxid;
- cu un acid;
- cu o sare.
Aplicaţii
Reacția de substituție este importantă, întrucât se obțin substanțe chimice cu multe utilizări:
- în metalurgie la obținerea metalelor (Cu, Zn, Pb, Fe,etc.) din oxizii lor naturali;
- în laborator la obținerea hidrogenului – H2;
- în laborator la obținerea unor metale – Fe, Zn,Hg, etc.
Pentru a înțelege reacția de substituție trebuie să înțelegi Seria activității chimice a metalelor.
Definiţie
Seria activității chimice a metalelor (Beketov-Volta) constituie o clasificare a metalelor după caracterul lor electrochimic, astfel metalele sunt așezate în ordinea descrescătoare a reactivităţii lor.
Cu cât metalul este așezat mai la începutul seriei de activitate, cu atât el cedează mai ușor electronii de valență, trecând la ionul corespunzător și, deci este mai reactiv din punct de vedere chimic.

Pentru a înțelege cum scade reactivitatea metalelor în acestă serie vă voi prezenta diferite experimente cu reacții de substituție.
Exemplu:
În reacția cu apa, sodiul reacționează energic (chiar violent) și la rece, pe când magneziul trebuie încălzit pentru a reacționa cu apa.
Aluminiul poate scoate orice metal aflat după el în serie (Zn, Fe, Pb,Cu,Hg, Ag) din compușii acestora, dar nu poate scoate potasiul (K), calciul (Ca), sodiul (Na), magneziul (Mg) din compușii lor.
Observaţie
Seria activității chimice a metalelor nu trebuie memorată. Când dorim să cunoaștem dacă o reacție de substituție are loc, atunci se studiază această serie.
V.2. Reacția metalelor cu apa.
Experiment
1. Reacția sodiului cu apa
Materiale necesare: cristalizor, apă, sodiu, fenolftaleină, clește metalic, pâlnie, chibrit.
Atenție
Experiment demonstrativ efectuat numai de către profesor!
Sodiul se poate aprinde în aer! Se formează hidroxid de sodiu extrem de caustic! Se formează hidrogen care poate exploda în oxigenul din aer!
Descrierea experimentului:
- Pune în cristalizor puțină apă și adaugă câteva picături de fenolftaleină.
- Cu multă grijă, taie o bucățică mică de sodiu sub petrol (metalele alcaline, fiind foarte reactive, se păstrează sub petrol).
- Cu un clește pune bucățica de sodiu în apa din cristalizor și acoperă cu pâlnia. Vino cu un băț de chibrit aprins deasupra pâlniei. Ce observi ?
Observaţie
Sodiul reacționează energic cu apa, înroșind fenolftaleina și când apropiem flacăra chibritului de pâlnie, are loc o pocnitură explozivă.
Concluzia experimentului:
Sodiul reacționează la rece și extrem de violent cu apa, cu formare de hidroxid de sodiu – NaOH (a înroșit fenolftaleina) și hidrogen – H2 (arde cu explozie în aer). Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
2Na + 2H2O = 2NaOH + H2 ↑
Experiment
2. Reacția magneziului cu apa
Materiale necesare: eprubetă, apă, pulbere de magneziu, fenolftaleină, clește de lemn, chibrit, spirtieră, spatulă.
warning
Atenție când lucrezi cu surse de foc !
Descrierea experimentului:
- Pune în eprubetă puțină apă și adaugă câteva picături de fenolftaleină.
- Cu spatula , pune puțină pulbere de magneziu în apă.
- Cu un clește de lemn ține eprubeta în flacăra spirtierei, rotind-o continuu.
- Vino cu un băț de chibrit aprins deasupra eprubetei. Ce observi ?
Observaţie
Magneziul reacționează la cald cu apa, înroșind fenolftaleina și gazul rezultat arde în aer.
Concluzia experimentului:
Magneziul reacționează la cald cu apa, cu formare de hidroxid de magneziu – Mg(OH)2 (a înroșit fenolftaleina) și hidrogen – H2 (arde cu flacără în aer). Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
Mg + 2H2O = Mg(OH)2 + H2 ↑
V.3. Reacția metalelor cu un acid.
Experiment
3. Reacția zincului cu acidul clorhidric
Materiale necesare: pahar Erlenmeyer, chibrit, spatulă, acid clorhidric, granulă de zinc, dop prevăzut cu un tub, eprubetă, lumânare.
warning
Atenție când lucrezi cu surse de încălzire ! Atenție, hidrogenul arde cu explozie în oxigen! Atenție, acidul clorhidric este caustic și îți poate provoca arsuri grave !
Descrierea experimentului:
- Pune în paharul Erlenmeyer puțin acid clorhidric și introdu apoi în acid, granula de zinc.
- Astupă paharul cu dopul prevăzut cu tub și vino cu un chibrit deasupra tubului. Ce observi ?
- Pune deasupra tubului o eprubetă cu gura în jos și, după 10 secunde , ia eprubeta și adu-o cu gura în flacăra lumânării. Ce observi ?
Observaţie
Gazul degajat este hidrogen, deoarece arde în oxigen cu o mică explozie (se aude un „ poc!”).
Concluzia experimentului:
Reacția zincului cu acid clorhidric - HCl decurge cu formare de clorură de zinc – ZnCl2 și hidrogen – H2. Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
Zn + 2HCl = ZnCl2 + H2 ↑
V.4. Reacția metalelor cu o sare.
Experiment
4. Reacția cuprului cu azotatul de argint
Materiale necesare: 2 pahare Berzelius, spatulă, sârmă de cupru spiralată, soluție de azotat de argint, soluție de sulfat de cupru, argint.
warning
Atenție, azotatul de argint este toxic și caustic (îți poate provoca arsuri) !
Descrierea experimentului:
- Pune într-un pahar Berzelius sârma de cupru spiralată și toarnă peste sârmă soluție de azotat de argint.
- Pune în alt pahar Berzelius un obiect de argint și toarnă peste el soluție de sulfat de cupru. Reacție lentă. Așteaptă mai mult timp până are loc reacția. Ce observi ?
Observaţie
Pe sârma de cupru se depune un metal argintiu.
Argintul nu reacționează cu sulfatul de cupru.
Concluzia experimentului:
Reacția cuprului cu azotatul de argint - AgNO3, decurge cu formare de azotat de cupru II – Cu(NO3)2 și argint – Ag. În seria activității chimice, cuprul este înaintea argintului și poate scoate argintul din compușii săi. Argintul nu reacționează cu sulfatul de cupru, fiincă argintul este după cupru și nu îl poate scoate din compușii săi.
Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag ↓
Experiment
5. Reacția zincului cu azotatul de plumb
Materiale necesare: pahar Berzelius, spatulă, cui zincat, soluție de azotat de plumb.
warning
Atenție, azotatul de plumb este toxic !
Descrierea experimentului:
- Pune în paharul Berzelius cuiul zincat.
- Toarnă peste sârmă soluție de azotat de plumb. Reacție lentă. Așteaptă mai mult timp până are loc reacția. Ce observi ?
Observaţie
Pe cuiul zincat se depune un metal gri-închis.
Concluzia experimentului:
Reacția zincului cu azotatul de plumb - Pb(NO3)2, decurge cu formare de azotat de zinc – Zn(NO3)2 și plumb – Pb. Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb ↓
Experiment
6. Amalgamul de argint sub formă de ace
Materiale necesare: creuzet, soluție de azotat de argint, o picătură de mercur.
warning
Experiment demonstrativ efectuat numai de profesor!
Atenție, azotatul de argint și mercurul sunt extrem de toxice ! Atenție, azotatul de argint este caustic și îți poate provoca arsuri !
Descrierea experimentului:
- Pune în creuzet o picătură de mercur.
- Toarnă peste mercur soluție de azotat de argint. Reacție lentă. Așteaptă mai mult timp până are loc reacția. Ce observi ?
Observaţie
Pe mercur s-au format niște ace lungi argintii.
Concluzia experimentului:
Reacția mercurului cu azotatul de argint - AgNO3, decurge cu formare de azotat de mercur – Hg(NO3)2 și argint – Ag. Argintul se aliază (se amestecă) la rece cu mercurul lichid, încă neconsumat, formând un aliaj numit amalgam de argint. Amalgamul de argint era folosit la plombarea dinților. Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
Hg + 2AgNO3 = Hg(NO3)2 + 2Ag ↓
Experiment
7. Reacția aluminiului cu clorura de mercur
Materiale necesare: eprubetă, soluție de clorură de mercur, o granulă de aluminiu, acid clorhidric, creuzet, pipetă.
Atenție
Experiment demonstrativ efectuat numai de profesor!
Atenție, clorura de mercur este extrem de toxică! Atenție, acidul clorhidric este caustic!
Descrierea experimentului:
Pune într-un creuzet granula de aluminiu și o picătură de acid clorhidric, pentru a îndepărta stratul de oxid de aluminiu.
Pune în eprubetă puțină soluție de clorură de mercur și adaugă granula de aluminiu curățată de stratul de oxid. Reacție lentă. Așteaptă mai mult timp până are loc reacția. Ce observi ?
Observaţie
Pe fundul eprubetei se observă mercurul lichid .
Concluzia experimentului:
Reacția aluminiului cu clorura de mercur - HgCl2, decurge cu formare de clorură de aluminiu – AlCl3 și mercur – Hg. Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
2Al + 3HgCl2 = 2AlCl3 + 3Hg ↓
Experiment
8. Reacția dintre fier și sulfatul de cupru
Materiale necesare: pahar Berzelius, soluție de sulfat de cupru (piatră vânătă), un cui de fier
Atenție
Atenție, sulfatul de cupru este toxic!
Descrierea experimentului:
Pune în pahar cuiul de fier și adaugă soluția de sulfat de cupru, astfel încât să acopere cam jumătate de cui.
Reacție lentă. Așteaptă mai mult timp până are loc reacția.
Ce observi?
Observaţie
Pe partea cuiului cufundată în soluție, s-a depus cupru roșiatic.
Concluzia experimentului:
Reacția fierului cu sulfatul de cupru - CuSO4, decurge cu formare de sulfat de fier II, verde – FeSO4 și cupru, roșiatic– Cu. Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
Fe + CuSO4 = FeSO4 + Cu ↓
V.5. Reacția nemetalelor cu un oxid metalic.
Experiment
9. Reacția dintre carbon și oxid cupric
Materiale necesare: eprubetă, oxid cupric, pulbere de cărbune, clește de lemn, chibrit, spirtieră, spatulă.
Atenție
Atenție când lucrezi cu surse de foc !
Descrierea experimentului:
- Pune în eprubetă puțină pulbere neagră de oxid cupric și de pulbere neagră de cărbune.
- Cu un clește de lemn ține eprubeta în flacăra spirtierei, rotind-o continuu.
- Vino cu un băț de chibrit aprins deasupra eprubetei. Reacție lentă. Încălzește mai mult timp până are loc reacția. Ce observi ?
Observaţie
Oxidul de cupru II reacționează la cald cu carbonul, iar gazul rezultat stinge flacăra chibritului.
Concluzia experimentului:
Oxidul de cupru II – CuO, reacționează la cald cu carbonul, cu formare de cupru metalic (roșiatic) și dioxid de carbon – CO2 (stinge flacăra). Această reacție servește la obținerea metalelor din oxizii lor naturali, în metalurgie. Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
2CuO + C = 2Cu ↓ + CO2 ↑
V.6. Sinteză recapitulativă - Reacția de substituție.
important
Reacția de substituție (simplă înlocuire) este reacția în care un element chimic înlocuiește un alt element chimic din substanța compusă.

- Ca reactanți avem o substanță simplă (A) și o substanță compusă (BC).
- Ca produși avem o substanță simplă (B) și o substanță compusă (AC).
- Substanța simplă ia locul primului element din substanță compusă și de aceea se mai numește și reacție de simplă înlocuire.
Ca tipuri de reacții de substituție avem:
I. Reacția dintre un metal și o substanță compusă (apă,oxid metalic, acid, sare)
2Na + 2H2O = 2NaOH + H2 ↑
Mg + 2H2O = Mg(OH)2 + H2 ↑
Zn + 2 HCl = ZnCl2 + H2 ↑
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag ↓
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb ↓
Hg + 2AgNO3 = Hg(NO3)2 + 2Ag ↓
2Al + 3HgCl2 = 2AlCl3 + 3Hg ↓
Fe + CuSO4 = FeSO4 + Cu ↓
Al + Fe2O3 = Al2O3 + Fe ↓
II.Reacția dintre un nemetal și o substanță compusă(oxid metalic)
C + 2CuO = 2Cu + CO2 ↑
C + H2O = CO + H2 ↑
3H2 + Fe2O3 = 3H2O + 2Fe ↓
H2 + CuO = H2O + Cu ↓
V.7. Calcule stoechiometrice
V.7.1. Calcule stoechiometrice cu exces de substanță.
Problemă model
1) x g fier reacționează cu o soluție de acid clorhidric, obținându-se 381 g clorură de fier II. Știind că s-a lucrat cu un exces de Fe de 20% , determină masa x de Fe introdusă în reacție.
Rezolvare:
- Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):

Aceasta se citește astfel: 1 mol de fier reacționează cu 2 moli de acid clorhidric și rezultă 1 mol de clorură de fier II și 1 mol de hidrogen.
- Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe:

- Calculăm masa molară a FeCl2:
μ FeCl2 = 1 ∙ AFe + 2 ∙ ACl = 56 + 2 ∙ 35,5= 56 + 71 = 127 g/mol

- Calculăm masa de fier în exces :
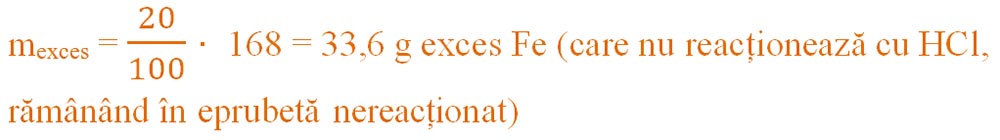
Calculăm masa x de Fe introdusă în reacție :
- x = 168 g + 33,6 g = 201,6 g Fe introdus în reacție
V.7.2. Calcule stoechiometrice cu randament.
Problemă model
1) Cel mai răspândit minereu al fierului este hematitul (oxid feric).

La scară industrială, fierul se obține pornind de la hematit (Fe2O3) printr-o reacţie de reducere directă cu carbon, la temperaturi de cca. 2000°C, în furnale (cuptoare înalte). În partea superioară a furnalului se introduce minereul de fier și carbonul sub formă de cocs .
Știind că din 1000 kg hematit s-a obținut 630 kg fier, calculează randamentul acestei reacții.
Rezolvare:
- Calculăm masa molară a Fe2O3 :
μ Fe2O3 = 2 ∙ AFe + 3 ∙ AO = 2 ∙ 56 + 3 ∙ 16= 112 + 48 = 160 g/mol
- Scriem datele problemei pe ecuația chimică și calculăm masa teoretică a fierului obținută :

- Aplicăm formula randamentului unei reacții chimice și calculăm randamentul , știind că mp = masa practică = 630 kg Fe :