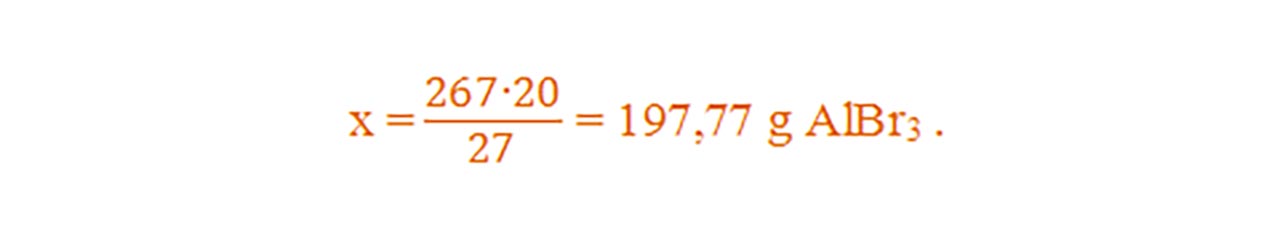VII. CALCULE PE BAZA FORMULEI CHIMICE.
7.1. Masă molară. Mol.
Molecula fiind formată din atomi, are dimensiuni foarte mici și masă foarte mică.
Definiție
Masa moleculară (notată cu M) este o mărime adimensională (un număr) care ne arată de câte ori este mai mare masa reală a unei molecule decât unitatea atomică de masă ( u.a.m.).
Ea se calculează ȋnsumând masele atomice relative ale tuturor atomilor moleculei.
Exemplu
1) Masa moleculară a apei (H2O) este:
MH2O = 2AH + 1AO = 2 + 16 = 18
Definiție
Masa molară (notată cu litera grecească miu = μ) este masa unui mol de substanță. Are ca unitate de măsură g/mol.
Masa molară este egală cu masa moleculară a substanței și conține NA particule (numărul lui Avogadro = 6,022 ∙ 1023 particule – atomi sau molecule).
Exemplu
2) Masa molară a fosfatului de magneziu: Mg3(PO4)2:
μ = 3AMg + 2AP + 8AO = 3 ∙ 24 + 2 ∙ 31 + 8 ∙ 16 = 72 + 62 + 128 = 262 g/mol
Definiție
Molul este unitatea de măsură în Sistemul Internațional, a cantității de substanță care conține un număr de particule egal cu numărul lui Avogadro
NA = 6,022 ∙1023
Numărul de moli se notează cu litera grecească „niu” (υ)și se calculează cu relația :
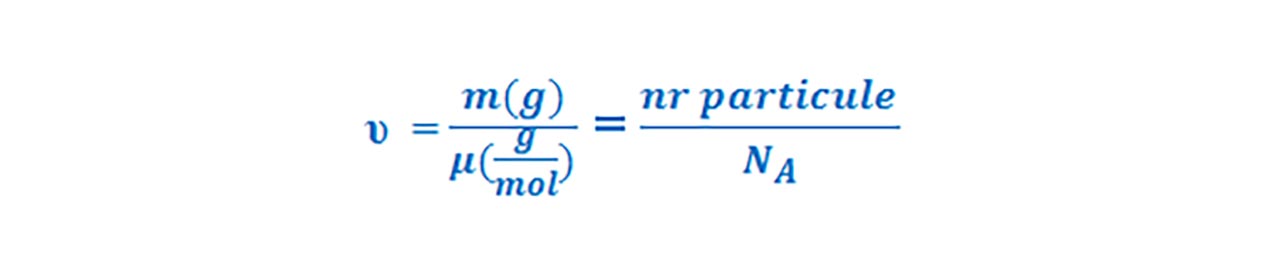
Amestecul echimolar este amestecul care are același număr de moli din fiecare component al amestecului.
Problemă model
1) Calculează numărul de moli din 150 g de acid sulfuric (H2SO4).
m = 150 g
υ = ?
Rezolvare:
Se calculează masa molară a H2SO4 :
- μ = 2AH + 1AS + 4AO = 2 ∙ 1 + 1 ∙ 32 + 4 ∙ 16 = 98 g/mol
Se calculează numărul de moli :
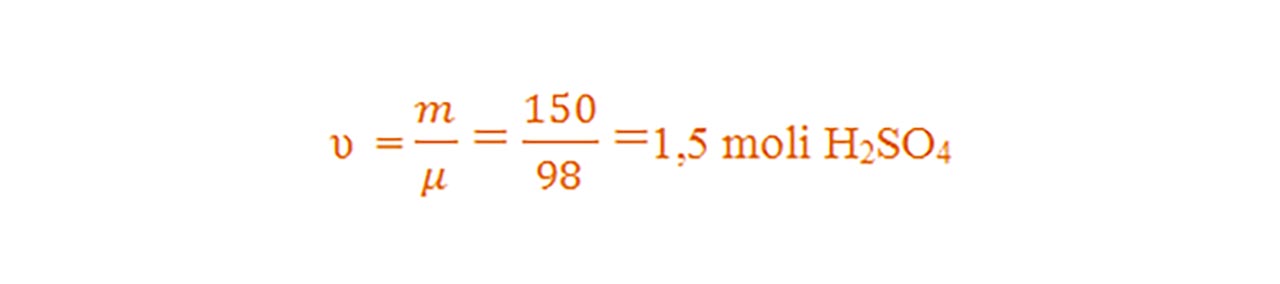
Problemă model
2) Calculează masa a 10 moli de Al2(PO4)3.
υ = 10 moli
m = ?
Rezolvare:
Se calculează masa molară a Al2(PO4)3 :
- μ = 2AAl + 3AP + 12AO = 2 ∙ 27 + 3 ∙ 31 + 12 ∙ 16 = 54 + 93 + 192 = 339 g/mol
- Se calculează masa din formula numărului de moli :
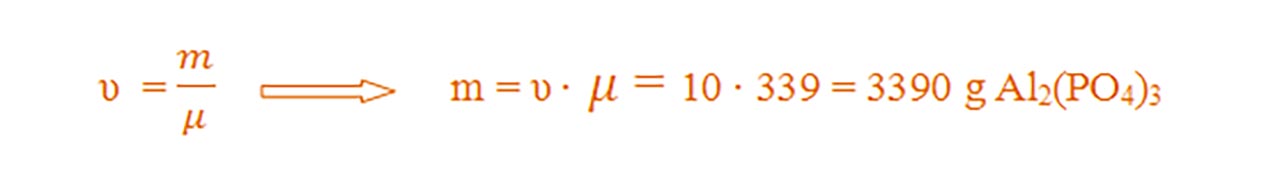
7.2. Calcule pe baza formulei chimice.
important
Știind formula chimică a unei substanțe, se poate determina:
1) Raportul atomic al elementelor componente este raportul între numărul de atomi din fiecare element component al substanței respective.
Pentru o substanță XaYbZc, raportul atomic este a : b : c
Exemplu:
Acidul sulfhidric - H2S are raportul atomic:
- 2H : 1S
Acidul carbonic - H2CO3 are raportul atomic:
- 2H : 1C : 3O
Fosfatul de mercur - Hg3(PO4)2 are raportul atomic:
- 3Hg : 2P : 8O = 1Hg : 1P : 4O
important
2) Raportul de masă este raportul între masele din fiecare element component al substanței respective.
Pentru o substanță XaYbZc, raportul atomic este aAX : bAY : cAZ
Exemplu:
Acidul sulfhidric - H2S are raportul de masă:
- 2AH : 1AS = 2 : 32 = 1 : 16
Acidul carbonic - H2CO3 are raportul de masă:
- 2AH : 1AC : 3AO = 2 : 12 : 48 = 1 : 6 : 24
Fosfatul de mercur - Hg3(PO4)2 are raportul de masă:
- 3AHg : 2AP : 8AO = 600 : 93 : 128
important
3) Compoziția procentuală de masă reprezintă masa fiecărui element conținută în 100g substanță.
a) Pornind de la formula chimică, se calculează masa molară și apoi cu regula de trei simplă se calculează procentul fiecărui element component.
Exemplu:
Pentru acidul carbonic - H2CO3:
μ = 2AH +1AC + 3AO = 2 + 12 + 48 = 62 g/mol
Dacă 62g H2CO3 conțin........2gH........12gC........ 48gO
Atunci 100g H2CO3 conțin ....xgH.........ygC..........zgO
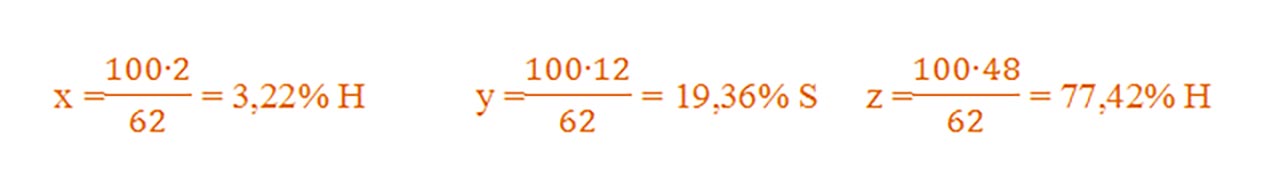
important
b) Pornind de la raportul de masă și apoi cu regula de trei simplă se calculează procentul fiecărui element component.
Exemplu:
Oxidul de fier III(Fe2O3 ) are raportul de masă Fe : O = 7 : 3. Calculează procentul fiecărui element component.
Adunăm 7gFe + 3 gO = 10 g de Fe2O3
Dacă în 10g Fe2O3 se găsesc ..........7gFe..........3gO
Atunci în 100g Fe2O3 se găsesc......xgFe.........ygO
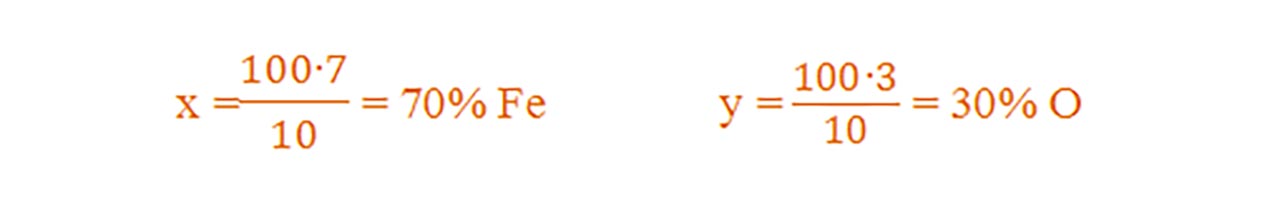
important
4) Masa unui element aflată într-o anumită masă de substanță compusă.
Pornind de la formula chimică, se calculează masa molară a substanței compuse și apoi cu regula de trei simplă se calculează masa fiecărui element component aflată în masa dată de substanță compusă.
Exemplu:
Ce masă de oxigen se află în 248 acid carbonic- H2CO3 ?
μ = 2AH + 1AC + 3AO = 2 + 12 + 48 = 62 g/mol
Dacă 62g H2CO3 conțin........ 48gO
Atunci 248g H2CO3 conțin .....xgO
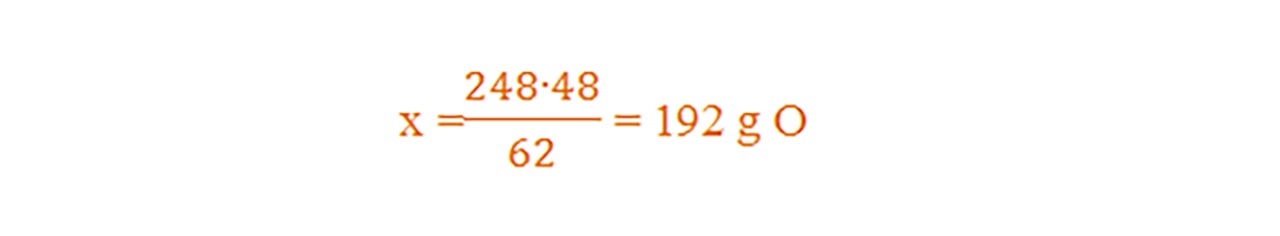
important
5) Masa unui substanțe compuse care conține o anumită masă de element.
Pornind de la formula chimică, se calculează masa molară a substanței compuse și apoi cu regula de trei simplă se calculează masa de substanță compusă aflată într-o anumită masă de element chimic.
Exemplu:
Ce masă de bromură de aluminiu- AlBr3 conține 20g de aluminiu ?
μ = 1AAl + 3ABr = 1 ∙ 27 + 3 ∙ 80 = 27 + 240 = 267 g/mol
Dacă 267g AlBr3 conține ............27g Al
Atunci xg AlBr3 conține...............20g Al