II.TRANSFORMĂRI CHIMICE ALE SUBSTANŢELOR
II.1. Reacții chimice.
În natură sau în laboratoarele de chimie au loc fenomene chimice, care schimbă compoziția substanțelor, numite și reacții chimice.
Definiţie
Reacția chimică este fenomenul prin care substanțele, denumite reactanți, se transformă în alte substanțe noi, denumite produși de reacție.

Observaţie
Reactanții sunt substanțele care participă (intră) la reacția chimică.
Produșii de reacție sunt substanțele care rezultă (ies) din reacție.
Reactanții și produșii de reacție pot fi substanțe simple sau substanțe compuse.
În timpul reacțiilor chimice se rup legăturile dintre substanțele reactanților și se formează alte legături între atomii(ionii) sau moleculele participante, rezultând substanțe chimice noi, cu aceleași elemente chimice.
Exemplu de reacție chimică:

Experiment
1. Arderea sulfului
Materiale necesare: pulbere de sulf, lingură de ars, spatulă, spirtieră, chibrit.
Atenţie!
Experiment demonstrativ efectuat numai de către profesor !
Atenție! Gazul rezultat, numit dioxid de sulf, este extem de toxic și inspirat, poate să vă ardă mucoasa nazală ! Deci, nu inspirați dioxidul de sulf ! Folosește nișa! Atenție când lucrezi cu surse de foc !
Descrierea experimentului:
- Pune un vârf de spatulă de pulbere de sulf în lingura de ars.
- Sub nișă (hotă), aprinde spirtiera și ține în vârful flăcării lingura de ars cu sulf.
- Sulful se aprinde ușor în prezența oxigenului din aer, formând un fum albicios, cu miros înțepător și iritant, de dioxid de sulf.
Observaţie
Pulberea galbenă de sulf arde în oxigenul din aer (gaz incolor, inodor, insipid) și formează un gaz albicios, cu miros înecăcios, de dioxid de sulf.
Concluzia experimentului:
Reactanții și produșii de reacție au proprietăți diferite, dar sunt formate din aceleași elemente chimice (sulf și oxigen).
S + O2 = SO2 (Dioxid de sulf)
II.2. Legea conservării masei. Legea conservării numărului de atomi.
Experiment
2. Legea conservării masei într-o reacție chimică
Materiale necesare: cântar sau balanță, creuzet, azotat de argint, cupru.
Atenţie!
Atenție, azotatul de argint, denumit și piatra iadului, este toxic și caustic și poate provoca arsuri în contact cu pielea!
Descrierea experimentului:
- Pune pe cântar sticla de ceas cu puțină soluție de azotat de argint și alături granula de cupru. Cântărește reactanții: m1 = 36,2 g
- Lasă sticla de ceas cu azotatul de argint pe cântar și adaugă cuprul în soluție.
- Așteaptă să se termine reacția chimică și măsoară masa produșilor de reacție m2 = 36,2 g
Observaţie
m1 = m2
Concluzia experimentului:
Masa reactanților este egală cu masa produșilor.
În 1756, chimistul rus Lomonosov descoperă o lege a naturii foarte importantă, numită Legea conservării masei. Această lege este demonstrată experimental, în 1774 de chimistul francez, Lavoisier, care o enunță astfel: „În natură, nimic nu se pierde, nimic nu se câștigă, totul se transformă ”.
Definiţie
Legea conservării(păstrării) masei în reacțiile chimice: Într-o reacție chimică, masa totală a reactanților este egală cu masa totală a produșilor de reacție.
Definiţie
Legea conservării numărului atomilor: Numărul atomilor intrați în reacție este egal cu numărul atomilor ieșiți din reacție.
Experiment
3. Cum reacționează reactanții între ei ?
Materiale necesare: cântar sau balanță, sulfat de cupru, pilitură de fier, apă, spatulă, 2 pahare Berzelius, baghetă.
Descrierea experimentului:
- Pune 4 g de sulfat de cupru într-un pahar Berzelius , adaugă apă și amestecă pentru a obține o soluție. În această soluție, adaugă 1,4 g pilitură de fier.
- Ce observi ?
Observaţie
Toată pilitura de fier a reacționat cu sulfatul de cupru și s-a transformat în cupru(metal roșiatic) și sulfat de fier (soluție verzuie).
- Pune 4 g de sulfat de cupru într-un pahar Berzelius , adaugă apă și amestecă pentru a obține o soluție. În această soluție, adaugă 2 g pilitură de fier.
- Ce observi ?
Observaţie
Nu toată pilitura de fier a reacționat cu sulfatul de cupru și s-a transformat în cupru și sulfat de fier. Cantitatea de fier care nu a reacționat, este în exces (în plus).
Concluzia experimentului:
Substanțele reacționează unele cu altele în cantități bine determinate ( adică, nu în orice cantitate ).
important
Reacțiile chimice au următoarele caracteristici :
- Reactanții nu se consumă în orice cantitate, ci în proporții bine determinate.
- Conservă felul și numărul elementelor chimice participante.
- Numărul atomilor intrați în reacție este egal cu numărul atomilor ieșiți din reacție (Legea conservării numărului atomilor).
- Masa totală a reactanților este egală cu masa totală a produșilor de reacție (Legea conservării masei).
II.3. Ecuații chimice (Stabilirea coeficienților unei ecuații).
Pentru a înțelege noțiunea de ecuație chimică, scriem reacția chimică de ardere a sulfului în oxigenul din aer:
S + O2 => SO2,
folosind simbolurile pentru substanțele simple și formulele chimice pentru substanțele compuse (compușii chimici).
Ca să ajungem de la o reacție chimică la o ecuație (egalitate) chimică, trebuie să aplicăm Legea conservării masei, implicit Legea conservării numărului de atomi, adică să facem bilanțul atomilor:
Începem cu atomii reactanților și continuăm cu aceeași specie de atomi din produșii de reacție.
Spunem: intră un atom de sulf (ne uităm în partea stângă a reacției) și iese tot un atom de sulf (ne uităm în partea dreaptă a ecuației).
Spunem: intră doi atomi de oxigen (ne uităm în partea stângă a reacției) și ies tot doi atomi de oxigen (ne uităm în partea dreaptă a ecuației).
Deci, este realizat bilanțul atomilor și putem pune, în loc de săgeată, semnul egal și asfel am scris ecuația reacției chimice.
S + O2 = SO2
important
Când nu avem egalitate dintre numărul atomilor de același fel (care intră și care rezultă din reacție), se trece un număr în fața simbolului sau formulei, număr numit coeficient stoechiometric, pentru a realiza bilanțul atomilor respectivi. Coeficientul 1 nu se scrie. Vom scrie ecuația chimică folosind coeficienții cei mai mici din cifre întregi și pozitive.
Definiţie
Ecuația chimică reprezintă notarea convențională a unei reacții chimice cu ajutorul simbolurilor și formulelor chimice, cu respectarea bilanțului atomilor din reacție.
Problemă model
1) Scrie ecuația reacției dintre hidrogen ( H2 ) și oxigen ( O2 ) :
Prima dată scriem reacția chimică, scriind în stânga reactanții și în dreapta produșii de reacție:
- H2 + O2 => H2O
Apoi facem bilanțul atomilor.
Intră 2 atomi de H și ies tot 2 atomi de H.
Intră 2 atomi de O și iese 1 atom de O. Pentru a realiza egalitatea atomilor de oxigen, punem coeficientul 2 în fața formulei apei: (Atenție ! Nu pune coeficienții în interiorul formulei, ci în fața ei!)
H2 + O2 => 2H2O. Dar, punând 2 în fața apei, acum vor ieși 4 atomi de hidrogen și am stricat egalitatea atomilor de H. Prin urmare, punem coeficientul 2 și în fața hidrogenului:
2H2 + O2 => 2 H2O.
Facem verificarea finală: intră 4 atomi de H (2 coeficientul ∙ 2 indicele H) și ies tot 4 atomi de H (2 coeficientul ∙ 2 indicele H).
Intră 2 atomi de O (1 coeficientul ∙ 2 indicele O) și ies tot 2 atomi de O (2 coeficientul ∙ 1 indicele O).
Odată terminat bilanțul atomilor, în loc de săgeată punem semnul egal, adică am scris ecuația chimică:
- 2H2 + O2 = 2 H2O
Problemă model
2) Scrie ecuația reacției dintre aluminiu ( Al ) și oxigen ( O2 ) :
Prima dată scriem reacția chimică, scriind în stânga reactanții și în dreapta produșii de reacție:
- Al + O2 => Al2O3 (oxid de aluminiu)
Apoi facem bilanțul atomilor.
Intră 1 atom de Al și ies 2 atomi de Al. Punem coeficientul 2 în fața simbolului Al:
- 2Al + O2 => Al2O3
Intră 2 atomi de O și ies 3 atomi de O. Pentru a realiza egalitatea atomilor de oxigen , punem coeficientul 2 în fața formulei oxidului de aluminiu și coeficientul 3 în fața oxigenului (Când avem într-o parte 2 atomi și în cealaltă parte 3 atomi, se face produsul lor) :
- 2Al + 3O2 => 2Al2O3
Dar, punând 2 în fața oxidului, am stricat egalitatea atomilor de Al (Acum ies 4 atomi de Al). Prin urmare, ștergem coeficientul 2 și punem coeficientul 4 și în fața aluminului. Vă recomand să scrieți cu creionul sau cu pix pilot, pentru a putea șterge cu guma:
- 4Al + 3O2 => 2Al2O3
Facem verificarea finală: intră 4 atomi de Al și ies tot 4 atomi de Al.
Intră 6 atomi de O (coeficientul 3 ori indicele 2) și ies tot 6 atomi de O (coeficientul 2 ori indicele 3).
Odată terminat bilanțul atomilor, în loc de săgeată punem semnul egal, adică am scris ecuația chimică:
- 4Al + 3O2 = 2Al2O3
Problemă model
3) Scrie ecuația reacției dintre aluminiu ( Al ) și acid clorhidric ( HCl ):
Prima dată scriem reacția chimică, scriind în stânga reactanții și în dreapta produșii de reacție :
- Al + HCl => AlCl3 (clorură de aluminiu) + H2
Apoi facem bilanțul atomilor.
Intră 1 atom de Al și iese 1 atom de Al.
Intră 1 atom de H și ies 2 atomi de H. Pentru a realiza egalitatea atomilor de H, punem coeficientul 2 în fața formulei acidului clorhidric (HCl) :
- Al + 2HCl => AlCl3 + H2
Intră 2 atomi de Cl și ies 3 atomi de Cl. Punem coeficientul 6 în fața HCl și coeficienul 2 în fața AlCl3 :
- Al + 6HCl => 2AlCl3 + H2. Observăm că am stricat atît bilanțul atomilor de Al și punem în fața Al coeficientul 2, cât și bilanțul atomilor de H și punem coeficientul 3 în fața H2 :
- 2Al + 6HCl => 2AlCl3 + 3H2
Facem verificarea finală: intră 2 atomi de Al și ies tot 2 atomi de Al.
Intră 6 atomi de H și ies tot 6 atomi de H (coeficientul 3 ori indicele 2).
Intră 6 atomi de Cl și ies tot 6 atomi de Cl (coeficientul 2 ori indicele 3).
Odată terminat bilanțul atomilor, în loc de săgeată punem semnul egal, adică am scris ecuația chimică :
- 2Al + 6HCl = 2AlCl3 + 3H2.
Problemă model
4) Scrie ecuația reacției dintre acid fosforic - H3PO4 și hidroxid de magneziu - Mg(OH)2 :
Prima dată scriem reacția chimică, scriind în stânga reactanții și în dreapta produșii de reacție:
- H3PO4 + Mg(OH)2 => Mg3(PO4)2 (Fosfat de magneziu) + H2O
Apoi facem bilanțul atomilor.
Când grupările radicalilor acizi se regăsesc și la produși, facem bilanțul grupărilor și nu al atomilor grupării (este mai simplu) și spunem intră 1 grupare fosfat (PO4) și ies 2 grupări fosfat (PO4)2. Punem coeficientul 2 în fața acidului fosforic:
- 2H3PO4 + Mg(OH)2 => Mg3(PO4)2 + H2O
Intră 1 atom de Mg și ies 3 atomi de Mg. Pentru a realiza egalitatea atomilor de Mg , punem coeficientul 3 în fața formulei hidroxidului de magneziu :
- 2H3PO4 + 3Mg(OH)2 => Mg3(PO4)2 + H2O
Intră 12 atomi de H (2x3=6 de la acidul fosforic + 3x2=6 de la hidroxidul de magneziu) și ies 2 atomi de H. Punem coeficientul 6 în fața apei:
- 2H3PO4 + 3Mg(OH)2 => Mg3(PO4)2 + 6H2O
Mai avem bilanțul atomilor de oxigen: intră 6 atomi de O (luăm numai oxigenul de la hidroxidul de magneziu, fiindcă O din acidul fosforic l-am luat la grupări) și ies tot 6 atomi de oxigen.
Facem verificarea finală: intră 12 atomi de H și ies tot 12 atomi de H.
Intră 2 grupări PO4 și ies tot 2 grupări fosfat.
Intră 3 atomi de Mg și ies tot 3 atomi de Mg.
Intră 6 atomi de O și ies tot 6 atomi de O.
Odată terminat bilanțul atomilor, în loc de săgeată punem semnul egal, adică am scris ecuația chimică:
- 2H3PO4 + 3Mg(OH)2 = Mg3(PO4)2 + 6H2O.
Experiment
4. Ce este un precipitat ?
Materiale necesare: sulfat de cupru (CuSO4), hidroxid de sodiu (NaOH) , apă, spatulă, 1 pahare Berzelius, baghetă, creuzet, pipetă.
Atenție!
Atenție, hidroxidul de sodiu, denumit și sodă caustică, poate produce arsuri grave în contact cu pielea!
Descrierea experimentului:
- Pune puțin sulfat de cupru cu spatula în paharul Berzelius, adaugă apă până se dizolvă toate cristalele.
- Toarnă acestă soluție într-un creuzet.
- Cu ajutorul pipetei pune soluție de hidroxid de sodiu în soluția de sulfat de cupru.
- Ce observi ?
Observaţie
În scurt timp se formează o substanță insolubilă în lichidul rezultat, gelatinoasă și albastră.
Concluzia experimentului:
Ecuația reacției chimice este : CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
Precipitatul albastru este hidroxidul de cupru : Cu(OH)2 .
important
După ce ai învățat să scrii o ecuație chimică, mai trebuie să ții cont de încă două aspecte pentru a scrie corect o ecuație chimică:
1) Dacă un produs de reacție iese sub formă gazoasă (spunem că se degajă), după formula lui se pune o săgeată în sus: ↑ . De exemplu , la experimentul nr.1, la arderea sulfului în oxigen, s-a degajat un gaz albicios, de dioxid de sulf. Deci, vom scrie ecuația chimică completă, astfel:
S + O2 = SO2 ↑
2) Dacă un produs de reacție iese sub formă de precipitat (substanță insolubilă), după formula lui se pune o săgeată în jos ( ↓). De exemplu, la experimentul nr. 4, vom scrie ecuația chimică completă, astfel:
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2 ↓
Ecuația chimică are o dublă semnificație:
Calitativă: indică natura reactanților și a produșilor de reacție.
2Al + 6HCl = 2 AlCl3 + 3 H2↑
Aluminiu + Acid clordidric se transformă în clorură de aluminiu + hidrogen↑
Cantitativă: indică raportul în care se combină reactanții pentru a forma produși de reacție.
2Al + 6HCl = 2 AlCl3 + 3 H2↑
2 moli de aluminiu + 6 moli de acid clordidric se transformă în 2 moli de clorură de aluminiu + 3 moli de hidrogen↑
2 atomi de aluminiu + 6 molecule de acid clordidric se transformă în 2 molecule de clorură de aluminiu + 3 molecule de hidrogen↑
II.4. Calcule stoechiometrice (pe baza ecuațiilor chimice).
Definiție
Stoechiometria este partea chimiei care se ocupă cu studiul cantitativ al reacțiilor chimice, adică calculul masei, volumului reactanților și produșilor de reacție.
important
Într-o reacție chimică, între cantitățile de reactanți și cele de produși de reacție există o relație de proporționalitate.
Problemă model
1) 20g de sulfat de cupru reacționează cu hidroxidul de sodiu.
Se cere :
a) Câți moli de hidroxid de sodiu reacționează cu 20 g de sulfat de cupru ?
b) Ce cantitate de sulfat de sodiu se obține ?
Rezolvare
- Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
- CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2 ↓
Aceasta se citește astfel: 1 mol de sulfat de cupru reacționează cu 2 moli de hidroxid de sodiu și formează 1 mol de sulfat de sodiu și 1 mol de hidroxid de cupru.
- Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe :
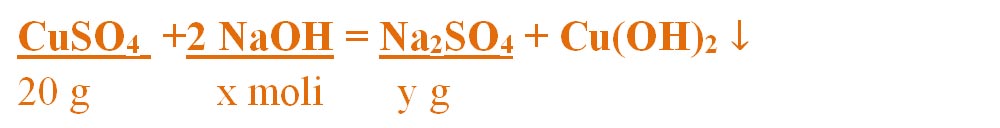
- Numai pentru substanțele subliniate, deasupra lor se notează masele molare înmulțite cu coeficienții respectivi din fața substanței, iar pentru cele care se dau sau se cer în moli se trece numărul de moli, astfel încât să avem aceeași unitate de măsură și sub substanță și deasupra ei.
Calculăm masele molare ale sulfatului de cupru și sulfatului de sodiu :
μCuSO4 = 1∙ ACu + 1 ∙ AS + 4 ∙ AO = 64 + 32 + 3 ∙ 16 = 96 + 48 = 144 g/mol
μNa2SO4 = 2 ∙ ANa + 1 ∙ AS + 4 ∙ AO = 2 ∙ 23 + 32 + 3 ∙ 16 = 46 + 32 + 48 = 126g/mol
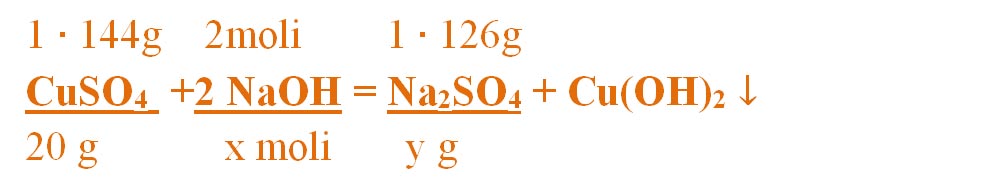
- Din proporțiile astfel obținute se calculează necunoscutele :
