III.TIPURI DE REACȚII CHIMICE. REACȚIA DE COMBINARE
Reacțiile chimice sunt de patru tipuri:
- Reacții de combinare;
- Reacții de descompunere;
- Reacții de substituție;
- Reacții de schimb.
III.1. Reacția de combinare.
Știind că următoarele două reacții sunt reacții de combinare, descoperă caracteristică comună a celor două reacții.
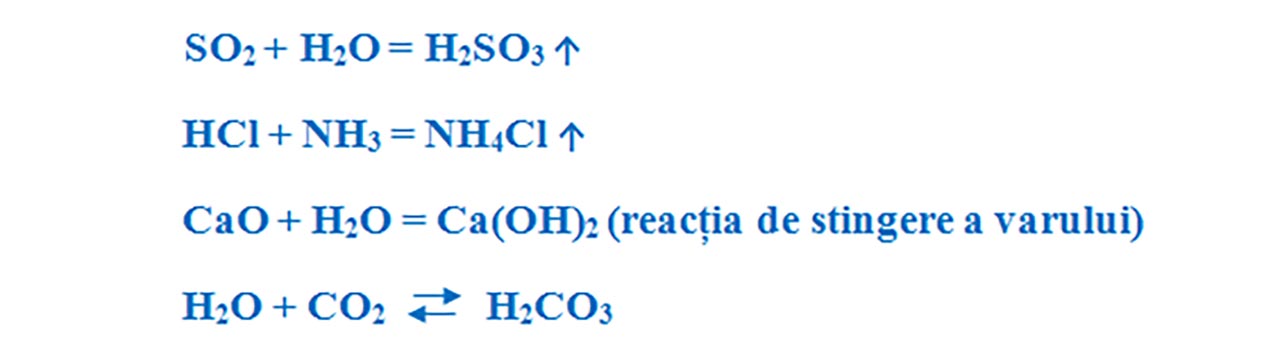
S + O2 = SO2 ↑
4Al + 3O2 = 2Al2O3
Observăm că avem doi reactanți și un singur produs de reacție.
Definiţie
Reacția de combinare este reacția în care se obține un singur produs de reacție prin unirea a mai multor reactanți (doi sau mai mulți).
important

Reactanții (A și B) pot fi atât substanțe simple (metale/ nemetale), cât și substanțe compuse.
Produșii reacției (C) de combinare sunt întotdeauna substanțe compuse.
important
- Reacția metalelor cu oxigenul (Reacție de ardere).
- Reacția nemetalelor cu oxigenul (Reacție de ardere).
- Reacția metalelor cu nemetalele.
- Reacția dintre două substanțe compuse.
Aplicaţii
Reacția de combinare este importantă întrucât se obțin substanțe chimice cu multe utilizări:
- var stins – Ca(OH)2;
- clorură de amoniu - NH4Cl;
- amoniac - NH3;
- acid clorhidric - HCl, etc.
III.2. Reacția metalelor cu oxigenul.
Experiment
1. Arderea cuprului
Materiale necesare: spirtieră, sârmă de cupru, chibrit, clește metalic.
Atenție!
Atenție când lucrezi cu surse de încălzire !
Descrierea experimentului:
- Încălzește sârma de cupru, cu ajutorul unui clește, în flacăra spirtierei.
- Ce observi ?
Observaţie
Sârma de cupru se înnegrește și arde cu o flacără verde.
Concluzia experimentului:
Cuprul se combină cu oxigenul din aer, la cald și formează oxid de cupru II (oxid cupric), de culoare neagră. Aceasta este o reacție de combinare, întrucât avem un singur produs de reacție.
2Cu + O2 = 2CuO (Oxid cupric)
Experiment
2. Arderea magneziului
Materiale necesare: spirtieră, panglică (pilitură) de magneziu, chibrit, clește metalic
Atenție!
Atenție când lucrezi cu surse de încălzire ! Nu privi flacăra orbitoare decât câteva secunde ! Altfel, îți poate afecta vederea! Pilitura de magneziu este inflamabilă ! Ai grijă să nu te arzi de la așchiile incandescente !
Descrierea experimentului:
- Încălzește panglica de magneziu, cu ajutorul unui clește, în flacăra spirtierei. Dacă ai pulbere de magneziu, presar-o direct în flacăra spirtierei.
- Ce observi ?
Observaţie
Panglica de magneziu se aprinde și arde cu o flacără extrem de stălucitoare. În urma arderii se obține o pulbere albă.
Concluzia experimentului:
Magneziul arde cu oxigenul din aer cu o flacără orbitoare, formând oxid de magneziu, de culoare albă. Aceasta este o reacție de combinare, întrucât avem un singur produs de reacție.
2Mg + O2 = 2MgO (Oxid de magneziu)
Experiment
3. Arderea fierului
Materiale necesare: spirtieră, pilitură de fier, chibrit, spatulă.
Atenție!
Atenție când lucrezi cu surse de încălzire ! Pilitura de fier este inflamabilă ! Ai grijă să nu te arzi de la așchiile incandescente !
Descrierea experimentului:
- Presară pilitură de fier în flacăra spirtierei
- Ce observi ?
Observaţie
Pilitura de fier se aprinde în oxigen și arde cu scântei strălucitoare.
Concluzia experimentului:
Fierul se combină cu oxigenul din aer, la cald și formează magnetita (oxid feroferic = FeO ∙ Fe2O3 ), de culoare neagră. Aceasta este o reacție de combinare, întrucât avem un singur produs de reacție. 3Fe + 2O2 = Fe3O4 (Magnetită)
Experiment
4. Arderea zincului
Materiale necesare:: spirtieră, pilitură de zinc, chibrit, spatulă
Atenție!
Atenție când lucrezi cu surse de încălzire ! Pilitura de zinc este inflamabilă ! Stai departe de scântei!
Descrierea experimentului:
- Presară pilitură de zinc în flacăra spirtierei.
- Ce observi ?
Observaţie
Pilitura de zinc se aprinde în oxigen și arde cu scântei verzi-albăstrui.
Concluzia experimentului:
Zincul se combină cu oxigenul din aer, la cald și formează oxid de zinc . Aceasta este o reacție de combinare, întrucât avem un singur produs de reacție.
2Zn + O2 = 2ZnO (Oxid de zinc)
III.3. Reacția nemetalelor cu oxigenul.
Experiment
5. Arderea carbonului
Materiale necesare: spirtieră, cărbune pisat, chibrit, spatulă, lingură de ars.
Atenție!
Atenție când lucrezi cu surse de încălzire ! Nu inspira fumul! Experimentul se efectuează sub nișă !
Descrierea experimentului:
- Pune într-o lingură de ars o cantitate mică de cărbune și încălzește-o în flacăra spirtierei (aragazului).
- După ce s-a aprins carbonul pune lingura de ars într-un pahar Berzelius și vino cu un chibrit deasupra sa.
- Ce observi ?
Observaţie
Carbonul se aprinde în oxigen și arde cu scântei. Dioxidul de carbon rezultat stinge flacăra chibritului.
Concluzia experimentului:
Carbonulul arde în oxigenul din aer, la cald și formează dioxid de carbon, un gaz incolor, care nu întreține arderea. Aceasta este o reacție de combinare, întrucât avem un singur produs de reacție.
C + O2 = CO2 (Dioxid de carbon) ↑ ( reacția de ardere completă a carbonului)
Experiment
6. Arderea sulfului
Materiale necesare: pulbere de sulf, lingură de ars, spatulă, spirtieră, chibrit.
Atenţie!
Experiment demonstrativ efectuat numai de către profesor !
Atenție! Gazul rezultat, numit dioxid de sulf, este extem de toxic și inspirat, poate să vă ardă mucoasa nazală ! Deci, nu inspirați dioxidul de sulf ! Folosește nișa! Atenție când lucrezi cu surse de foc !
Descrierea experimentului:
- Pune un vârf de spatulă de pulbere de sulf în lingura de ars.
- Sub nișă (hotă), aprinde spirtiera și ține în vârful flăcării lingura de ars cu sulf.
- Sulful se aprinde ușor în prezența oxigenului din aer, formând un fum albicios, cu miros înțepător și iritant, de dioxid de sulf.
Observaţie
Pulberea galbenă de sulf arde în oxigenul din aer (gaz incolor, inodor, insipid) și formează un gaz albicios, cu miros înecăcios, de dioxid de sulf.
Concluzia experimentului:
Reactanții și produșii de reacție au proprietăți diferite, dar sunt formate din aceleași elemente chimice (sulf și oxigen).
S + O2 = SO2 (Dioxid de sulf)
III.4. Reacția metalelor cu nemetalele. Indicatorii de culoare pentru acizi și baze.
Experiment
7. O reacție exotermă
Materiale necesare: eprubetă, chibrit, spatulă, pilitură de fier, pulbere de sulf, spirtieră, cântar.
Atenție!
Experiment demonstrativ efectuat numai de către profesor !
Atenție când lucrezi cu surse de încălzire ! Atenție, reacția fierului cu sulful este o reacție puternic exotermă ( degajare mare de căldură) ! Pentru a nu exploda amestecul, se încălzește până la apariția unor puncte incandescente, după care se oprește încălzirea !
Descrierea experimentului:
Pune în eprubetă pilitura de fier și pulberea de sulf în proporție de 0,87g Fe : 0,5g S.
Încălzește la flacăra spirtierei acest amestec până la apariția unor puncte incandescente (roșii). Stinge spirtiera.
Ce observi ?
Observaţie
Fierul se combină la cald cu sulful. Se formează o substanță neagră.
Concluzia experimentului:
Fierul reacționează cu sulful și formează sulfura de fier II, de culoare neagră. Reacția fierului cu sulful este o reacție de combinare, întrucât avem un singur produs de reacție.
Fe + S = FeS (Sulfură de fier II)
Experiment
8. Reacția dintre sulf și mercur
Materiale necesare: mojar cu pistil, sulf, o picătură de mercur.
Atenție!
Experiment demonstrativ efectuat numai de către profesor !
Atenție! Mercurul este extrem de toxic ! Nu inhala vaporii săi! Nu îl atinge și nu il gusta!
Descrierea experimentului:
- Pune într-un mojar pulbere de sulf și o picătură de mercur și amestecă cu pistilul.
- Ce observi ?
Observaţie
În scurt timp se observă formarea unei pulberi de culoare neagră.
Concluzia experimentului:
Mercurul reacționează cu sulful și formează sulfura de mercur, de culoare neagră. Reacția mercurului cu sulful este o reacție de combinare, întrucât avem un singur produs de reacție.
Hg + S = HgS (Sulfură de mercur)
Experiment
9. Reacția magneziului cu clorul
Materiale necesare: pahar Berzelius, clorat de potasiu, acid clorhidric concentrat, magneziu pulbere, lingură de ars, spirtieră, chibrit, sticlă de ceas, spatulă .
Atenție!
Experiment demonstrativ efectuat numai de către profesor !
Experimentul se realizează sub nișă !Nu inspira clorul! Este extrem de toxic și îți poate afecta plămânii !
Descrierea experimentului (Partea 1):
- Pune în pahar un vârf de spatulă și adaugă câteva picături de acid clorhidric concentrat. Acoperă imediat paharul cu o sticlă de ceas.
- Ce observi ?
Observaţie (Partea 1)
Se degajă un gaz galben-verzui.
Cloratul de potasiu cu acidul clorhidric produce clor gazos.
KClO3 + 6HCl = KCl + 3H2O + 3Cl2 ↑
Descrierea experimentului (Partea 2):
Încălzește în lingura de ars pulberea de magneziu până la incandescență.
Introdu magneziu incandescent în paharul cu clor.
Ce observi ?
Observaţie (Partea 2)
Magneziul reacționează cu clorul.
Concluzia experimentului:
Magneziul reacționează cu clorul, la cald și formează clorura de magneziu, sub forma unui gaz alb. Este o reacție de combinare, întrucât avem un singur produs de reacție.
Mg + Cl2 = MgCl2 (Clorură de magneziu)
Experiment
10. Reacția aluminiului cu iodul
Materiale necesare: pulbere de aluminiu, cristale de iod, pulverizator cu apă, cristalizor, nișă
Atenție!
Experiment efectuat numai de profesor sub nișă!
Vaporii de iod sunt toxici și iritanți pentru plămâni și iodura de aluminiu este toxică ! Reacția este violentă și are loc cu mare degajare de căldură !
Descrierea experimentului:
Pune o cantitate foarte mică de pulbere de magneziu într-un cristalizor și adaugă câteva cristale de iod.
Pulverizează peste acest amestec puțină apă.
Lasă reacția să aibă loc sub nișă și îndepărtează-te.
Ce observi ?
Observaţie
Iodul reacționează energic cu aluminiul, cu degajare de căldură.
Concluzia experimentului:
Iodul reacționează cu aluminiul cu formarea iodurii de aluminiu. Apa are rol de catalizator în reacție (nu participă la reacție și mărește viteza reacției).
2Al +3I2 = 2AlI3
Experiment
11. Acizii și indicatorii de culoare
Materiale necesare: 4 eprubete, soluție de acid clorhidric, indicatori de culoare (turnesol, fenolftaleină, metilorange ), hârtie de pH (care arată caracterul unei soluții- acid, neutru sau bazic).
Atenție!
Acizii sunt caustici și îți pot produce arsuri în contact cu pielea!
Descrierea experimentului (Partea 1):
- Pune în fiecare eprubetă 2 mL de acid.
- Picură în prima eprubetă o picătură de soluție violetă de turnesol (hârtie de turnesol).
- Ce observi ?
Observaţie (Partea 1)
Acidul înroșește turnesolul.
Descrierea experimentului (Partea 2):
Picură în a doua eprubetă o picătură de soluție incoloră de fenolftaleină.
Ce observi ?
Observaţie (Partea 2)
Acidul nu schimbă culoarea fenolftaleinei.
Descrierea experimentului (Partea 3):
- Picură în a treia eprubetă o picătură de soluție portocalie de metilorange.
- Ce observi ?
Observaţie (Partea 3)
Acidul înroșește metilorange-ul.
Descrierea experimentului (Partea 4):
Pune în a patra eprubetă o bucată de hârtie de pH universal.
Ce observi ?
Observaţie (Partea 4)
Acidul colorează hârtia de pH în portocaliu, cu un pH de 2,5, ceea ce arată un acid, deoarece este mai mic decât 7.
Prin noțiunea de pH se exprimă cantitativ aciditatea (sau bazicitatea) unei substanțe.
- Soluțiile cu pH <7 sunt acide.
- Soluțiile cu pH =7 sunt neutre.
- Soluțiile cu pH >7 sunt bazice.
Concluzia experimentului:
Acizii înroșesc turnesolul și metilorange-ul și nu schimbă culoarea fenolftaleinei.
Experiment
12. Bazele și indicatorii de culoare
Materiale necesare: 4 eprubete, soluție de hidroxid de sodiu, indicatori de culoare (turnesol, fenolftaleină, metilorange), hârtie de pH (care arată caracterul uenei soluții- acid, neutru sau bazic).
Atenție!
Bazele sunt caustice și îți pot produce arsuri în contact cu pielea!
Descrierea experimentului (Partea 1):
Pune în fiecare eprubetă 2 mL de hidroxid .
Picură în prima eprubetă o picătură de soluție violetă de turnesol (hârtie de turnesol)
Ce observi ?
Observaţie (Partea 1)
Turnesolul în mediul bazic se albăstrește.
Descrierea experimentului (Partea 2):
Picură în a doua eprubetă o picătură de soluție incoloră de fenolftaleină.
Ce observi ?
Observaţie (Partea 2)
Fenolftaleina se colorează în mediul bazic în roșu-carmin.
Descrierea experimentului (Partea 3):
- Picură în a treia eprubetă o picătură de soluție portocalie de metilorange.
- Ce observi ?
Observaţie (Partea 3)
Metilorange-ul se colorează în mediul bazic în galben.
Descrierea experimentului (Partea 4):
Pune în a patra eprubetă o bucată de hârtie de pH universal.
Ce observi ?
Observaţie (Partea 4)
Hidroxidul colorează hârtia de pH în albastru- violet, cu un pH de 13, ceea ce arată o bază, deoarece este mai mare decât 7.
Prin noțiunea de pH se exprimă cantitativ aciditatea (sau bazicitatea) unei substanțe.
- Soluțiile cu pH <7 sunt acide.
- Soluțiile cu pH =7 sunt neutre.
- Soluțiile cu pH >7 sunt bazice.
Concluzia experimentului:
Bazele înroșesc fenolftaleina, albăstresc turnesolul și îngălbenesc metilorange-ul.
III.5. Reacția dintre un nemetal cu hidrogen.
Experiment
13. Reacția dintre hidrogen și oxigen
Materiale necesare: eprubetă, clește de lemn, pulbere de magneziu, apă, spirtieră, trepied cu sită, chibrit, spirt, spirtieră.
Atenție!
Atenție când lucrezi cu surse de foc!
Descrierea experimentului:
Pune pulbere de magneziu și apă în eprubetă și încălzește-o cu ajutorul cleștelui de lemn în flacăra spirtierei.
Vino cu un băț de chibrit aprins la gura eprubetei pentru a aprinde hidrogenul obținut în pahar.
Ce observi ?
Observaţie
Hidrogenul arde în oxigenul din aer.
Concluzia experimentului:
Hidrogenul arde în prezența oxigenului din aer și formează vapori de apă.
O2 + 2H2 = 2H2O↑
Hidrogenul se combină aproape cu toate nemetalele la cald.
Industrial acidul clorhidric se obține prin sinteza clorului cu hidrogenul .
Cl2 + H2 = 2HCl ↑
S + H2 = H2S ↑
III.6. Reacția de combinare dintre două substanțe compuse.
Experiment
14. Reacția dioxidului de sulf cu apa
Materiale necesare: pulbere de sulf, lingură de ars, spatulă, spirtieră, chibrit, pahar Berzelius, hârtie de filtru îmbibată cu apă, hârtie de turnesol.
Atenție!
Experiment demonstrativ efectuat numai de către profesor !
Atenție! Gazul rezultat, numit dioxid de sulf, este extem de toxic și inspirat, poate să vă ardă mucoasa nazală ! Deci, nu inspirați dioxidul de sulf ! Folosește nișa! Atenție când lucrezi cu surse de foc !
Descrierea experimentului:
Arde puțin sulf într-o lingură de ars, în flacăra unei spirtiere.
După aprinderea sulfului, introdu lingura de ars în pahar și acoperă-l cu hârtia de filtru umedă și pe cea de turnesol.
Ce observi ?
Observaţie
Pulberea galbenă de sulf arde în oxigenul din aer și formează un gaz albicios, cu miros înecăcios, de dioxid de sulf. Dioxidul de sulf cu apa înroșește hârtia de turnesol.
Concluzia experimentului:
Dioxidul de sulf reacționează cu apa, formând acidul sulfuros, care înroșește turnesolul.
SO2 + H2O = H2SO3 (Acid sulfuros)
Experiment
15. Reacția amoniacului cu acidul clorhidric
Materiale necesare: acid clorhidric concentrat, amoniac, bețigașe de urechi.
Atenție!
Acidul clorhidric este caustic și îți poate provoca arsuri grave ! Nu inspira fumul alb de clorură de amoniu, este toxică !
Descrierea experimentului:
- Înmoaie un bețigaș cu vată în acidul clorhidric și celălalt în amoniac. Apropie-le
- Ce observi ?
Observaţie
În scurt timp se observă formarea unei fum de culoare albă.
Concluzia experimentului:
Acidul clorhidric reacționează cu amoniacul și formează clorura de amoniu, sub forma unui gaz alb. Reacția acidului clorhidric cu amoniacul este o reacție de combinare, întrucât avem un singur produs de reacție.
HCl + NH3 = NH4Cl ↑ (Clorura de amoniu)
Experiment
16. Reacția oxidului de calciu cu apa (stingerea varului)
Materiale necesare: var nestins (oxid de calciu), apă, pahar, fenolftaleină.
Descrierea experimentului:
- Pune într-un pahar var nestins (CaO) și adaugă apă. Lasă câteva minute să se decanteze și adaugă o picăură de fenolftaleină. Ce observi ?
- Ce observi ?
Observaţie
Varul reacționează cu apa și înroșește fenolftaleina.
Concluzia experimentului:
Oxidul de calciu reacționează cu apa și formează hidroxid de calciu, care înroșește fenolftaleina. Este o reacție de combinare, întrucât avem un singur produs de reacție.
Reacția de stingere a varului
CaO (Var) + H2O = Ca(OH)2 (Hidroxid de calciu sau var stins)
Experiment
17. Reacția dintre dioxidul de carbon și apă (obținerea sifonului)
Materiale necesare: bicarbonat de sodiu,oțet, apă, pahar, hârtie de turnesol (hârtie de pH), flacon prevăzut cu un tub.
Descrierea experimentului:
Pune apa într-un pahar.
Pune în flacon oțet și adaugă bicarbonatul de sodiu.
Închide repede flaconul și introdu tubul său în apa din pahar.
Când barbotarea dioxidului de carbon se încheie, adaugă hârtia de turnesol ( sau pH) în apa din pahar.
Ce observi ?
Observaţie
Oțetul reacționează cu bicarbonatul de sodiu și degajă dioxid de carbon.
Prin barbotarea dioxidului de carbon în apă, aceasta se acidulează, înroșind hârtia de turnesol.
Concluzia experimentului:
Dioxidul de carbon reacționează cu apă, formând acid carbonic.
Acidul carbonic este cel mai slab acid anorganic și instabil, deoarece se descompune în dioxid de carbon și apă, când este lăsat descoperit.
Această reacție este reversibilă (poate avea loc în ambele sensuri).
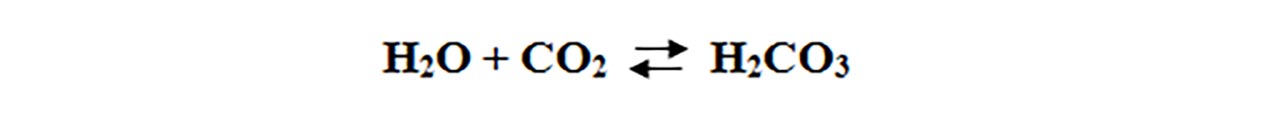
Aplicații
Apa carbogazoasă sau sifonul este apa în care, prin creșterea presiunii, a fost dizolvat dioxid de carbon (CO2) în concentrații reduse (0,2%–1,0%) determinând formarea de acid carbonic (H2CO3) care dă apei un gust ușor acid și un pH între 3 și 4.
Apele carbogazoase naturale din staţiuni ca : Borsec, Tuşnad, Vatra Dornei, Covasna, Buziaş reprezintă una dintre comorile României.
Zăcământul de apă minerală carbogazoasă este rezultatul unui proces complex și de lungă durată care are loc în profunzimea Munților Carpați, în rocile de natură vulcanică, la mare adâncime, prin amestecul apei meteorice cu dioxidul de carbon.
Aparatul de făcut sifon acasă are o butelie cu CO2, care cu apa pusă în sticlă obții sifon sau sucuri carbogazoase.

Reține!
Definiţie
Reacția de combinare este reacția în care se obține un singur produs de reacție prin unirea a mai multor reactanți (doi sau mai mulți).
important

Reactanții (A și B) pot fi atât substanțe simple (metale/ nemetale), cât și substanțe compuse.
Produșii reacției (C) de combinare sunt întotdeauna substanțe compuse.
important
Reacția de combinare poate avea loc între:
Un metal cu oxigen = oxid metalic
4Al + 3O2 = 2Al2O3
3Fe + 2O2 = Fe3O4
Un nemetal cu oxigen = oxid nemetalic
- S + O2 = SO2
Un metal cu un nemetal = sare
Fe + S = FeS
2Fe + 3Cl2 = 2FeCl3
Cu + Cl2 = CuCl2
Un nemetal cu hidrogen = acid sau apă( în cazul oxigenului)
Cl2 + H2 = 2HCl ↑
S + H2 = H2S ↑
O2 + 2H2 = 2H2O↑
- Două substanțe compuse = substanță compusă
III.7. Calcule stoechiometrice.
III.7.1. Calcule stoechiometrice cu puritatea unei substanțe.
Problemă model
1) O sârmă de alamă de 70 g conține 60% cupru. Ea este încălzită în flacăra unei spirtiere. Determină cantitatea de oxid cupric obținută.
Rezolvare:
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
2Cu + O2 = 2CuO
Aceasta se citește astfel: 2 moli de cupru reacționează cu 1 mol de oxigen și formează 2 moli de oxid cupric.
Aflăm cantitatea de cupru din aliajul său numit alamă :

- Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe:
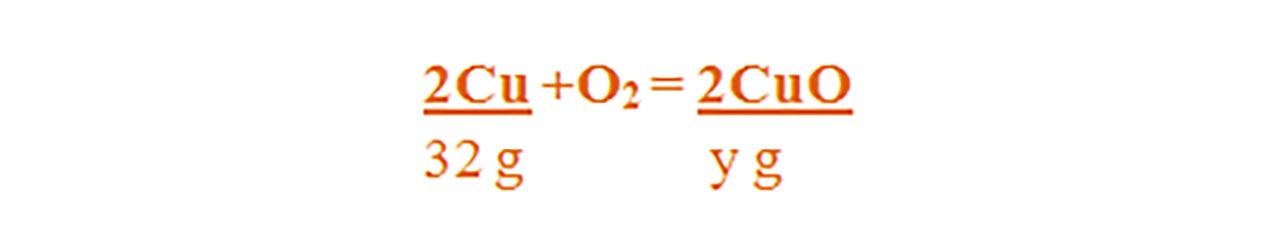
Numai pentru substanțele subliniate, deasupra lor se notează masele molare înmulțite cu coeficienții respectivi din fața substanței.
Calculăm masa molară a oxidului de cupru II :
μCuO = 1∙ ACu + 1 ∙ AO = 64 + 16 = 80 g/mol
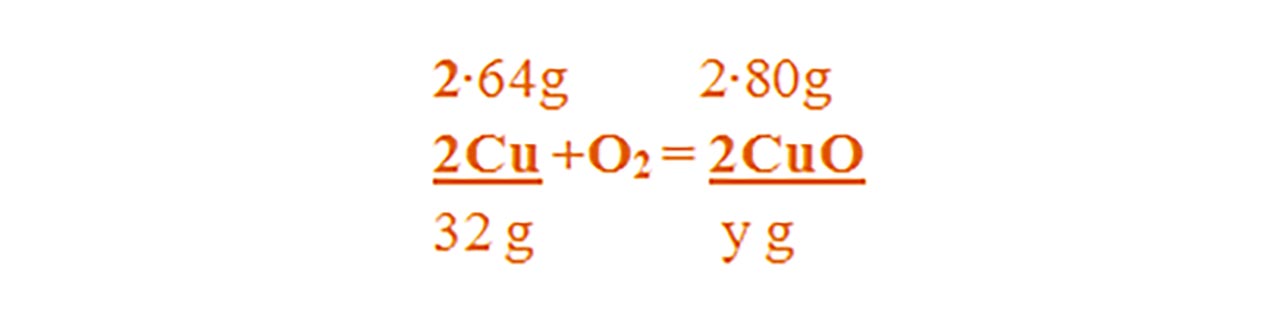
- Din proporțiile astfel obținute se calculează necunoscutele :
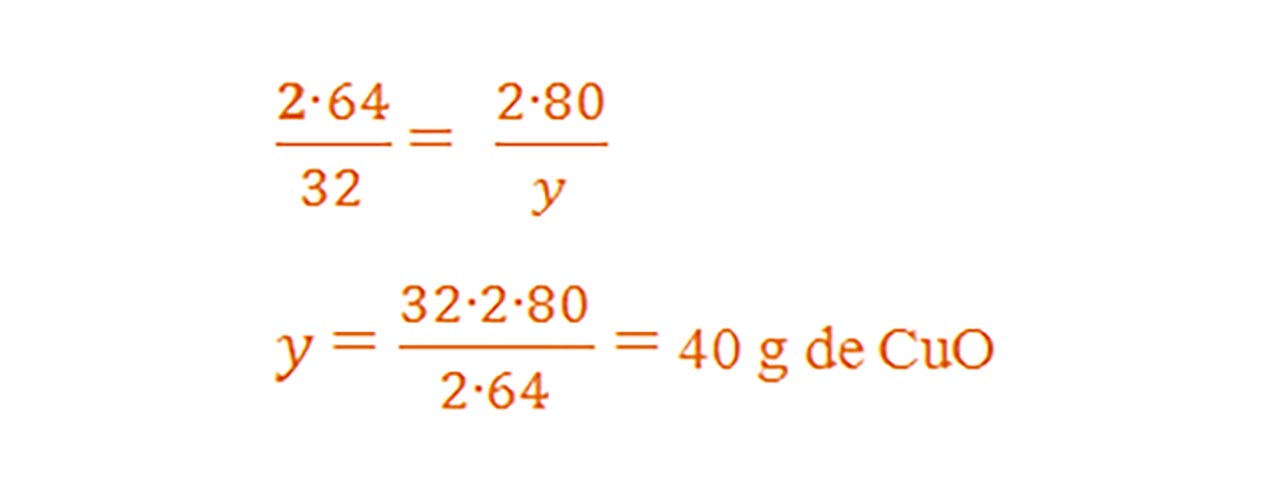
Problemă model
2) 44 g oțel reacționează cu oxigenul la cald. Știind că se obține 60 g magnetită, află procentul de fier și al celuilalt element din oțel.
Rezolvare:
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
3Fe +2O2 = Fe3O4
Aceasta se citește astfel: 3 moli de fier reacționează cu 2 moli de oxigen și formează 1 mol de magnetită.
Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe :
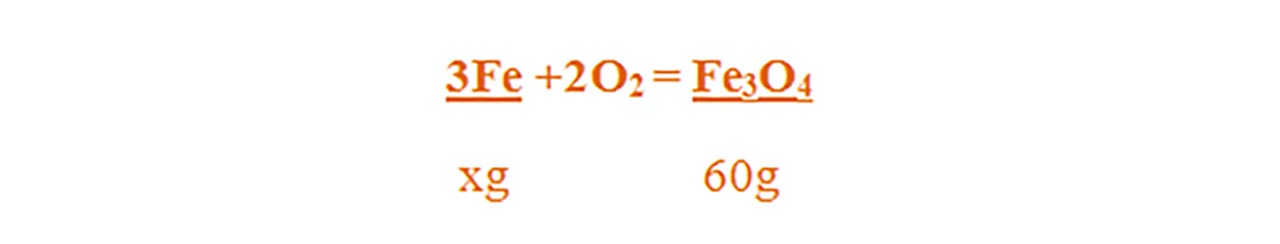
Numai pentru substanțele subliniate, deasupra lor se notează masele molare înmulțite cu coeficienții respectivi din fața substanței.
Calculăm masa molară a magnetitei :
μFe3O4 = 3 ∙ AFe + 4 ∙ AO = 3∙ 56 + 4 ∙ 16 = 168 + 64 = 232 g/mol
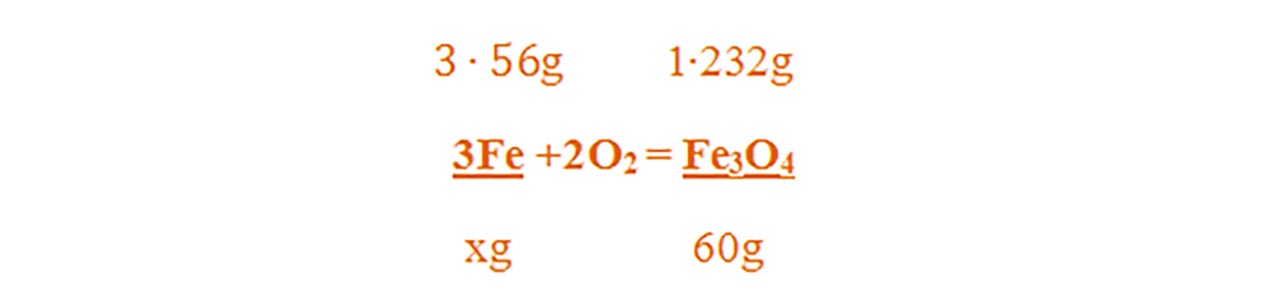
- Din proporțiile astfel obținute se calculează necunoscutele :
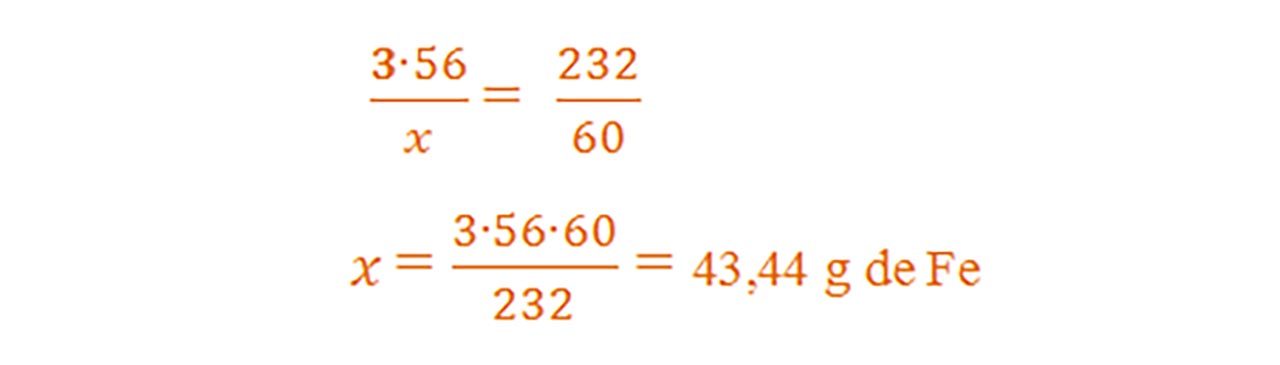
- Aflăm procentul de fier din aliajul său, numit oțel cu regula de trei simplă :
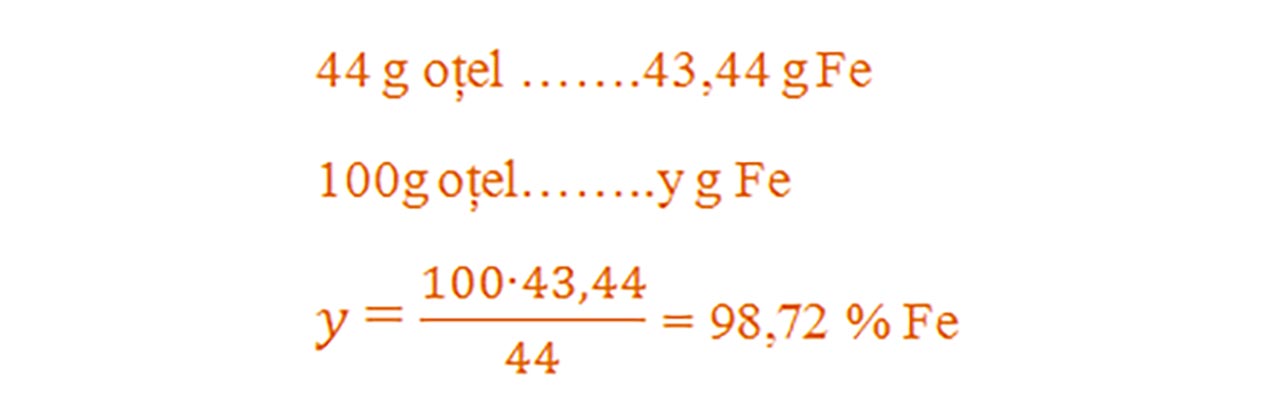
- Oțelul este aliajul fierului cu carbonul. Aflăm procentul carbonului din oțel: 100- 98,72 = 1,28 % C.
III.7.2. Calcule stoechiometrice cu concentrații procentuale de masă și cu volum molar.
Definiție
Un mol din orice gaz ocupă în condiții normale de temperatură și presiune un volum, numit volum molar = Vm = 22,4 L
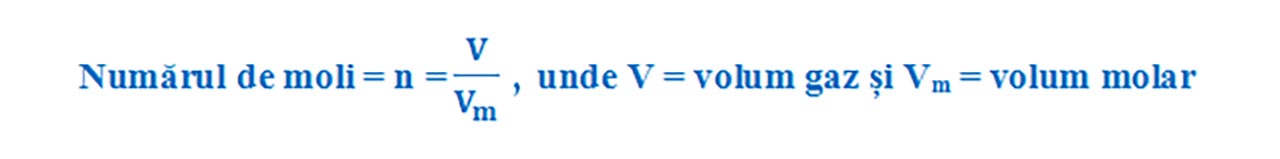
Problemă model
1) 365 g soluție de acid clorhidric reacționează cu amoniac.
Se cere:
a) Ce cantitate de clorură de amoniu se obține ?
b) Ce volum de amoniac este necesar pentru a reacționa cu acidul clorhidric ?
Rezolvare:
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
HCl + NH3 = NH4Cl
Aceasta se citește astfel: 1 mol de acid clorhidric reacționează cu 1 mol de amoniac și formează 1 mol de clorură de amoniu.
Aflăm cantitatea de acid clorhidric din soluția dată:
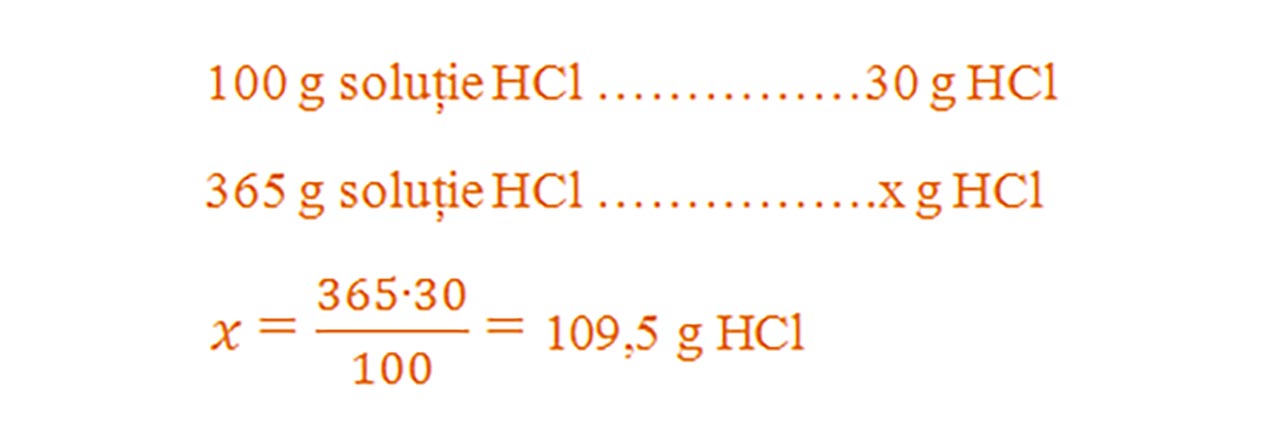
- Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe :
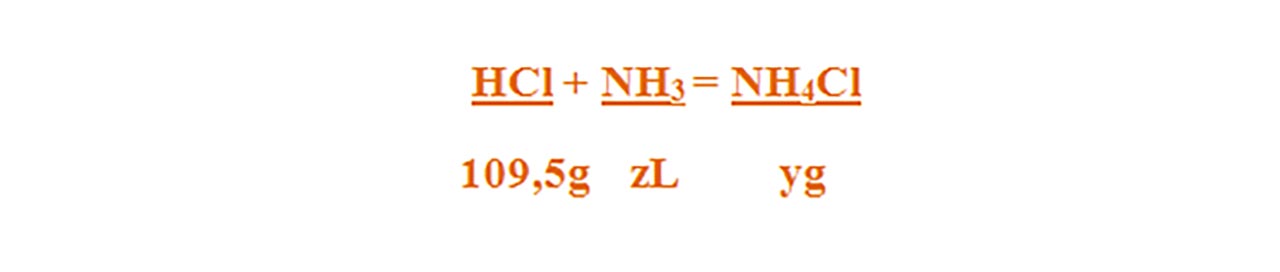
Numai pentru substanțele subliniate, deasupra lor se notează masele molare înmulțite cu coeficienții respectivi din fața substanței.
Calculăm masa molară a HCl și NH4Cl :
μHCl = 1∙ AH + 1 ∙ ACl = 1 + 35,5 = 36,5 g/mol
μNH4Cl = 1∙ AN + 4 ∙ AH + 1 ∙ ACl = 14 + 4 ∙ 1 + 35,5 = 53,5 g/mol
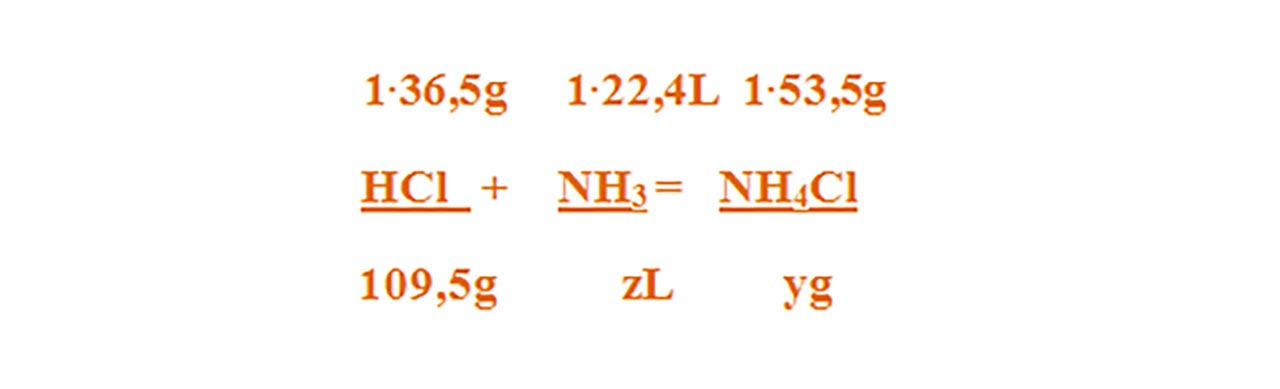
- Din proporțiile astfel obținute se calculează necunoscutele :
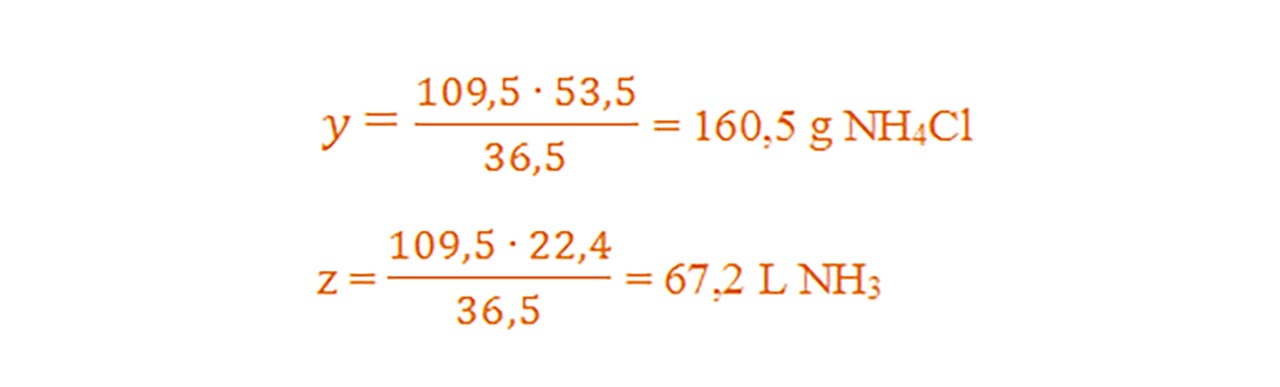
Problemă model
2) Într-un vas se găsește 9066,67 g soluție de apă oxigenată 3%. Vasul se lasă descoperit și la lumină pentru a descompune apa oxigenată.
Se cere: a) Câți litri de oxigen se degajă ?
b) Ce cantitate de apă rămâne în vas după descompunerea completă a apei oxigenate ?
Rezolvare:
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
2H2O2 = 2H2O + O2 ↑
Aceasta se citește astfel: 2 moli de apă oxgenată se descompune în 2 moli de apă și 1 mol de oxigen.
Aflăm cantitatea de apă oxigenată din soluția dată :
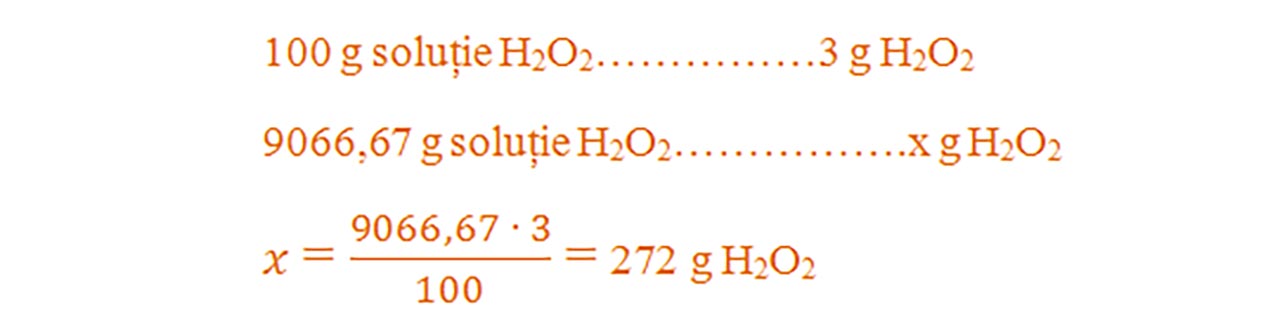
- Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe:
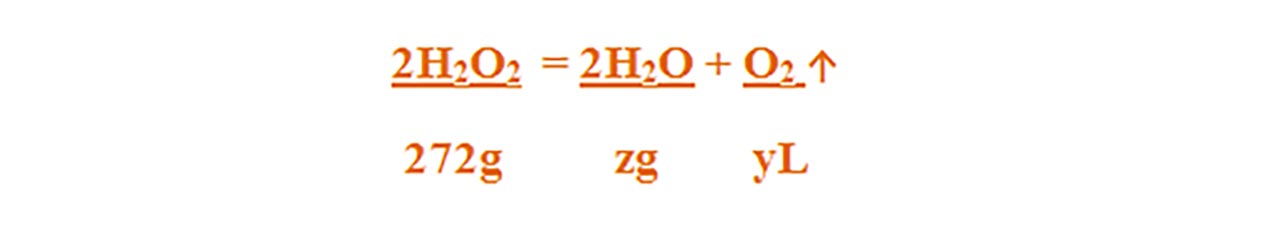
Numai pentru substanțele subliniate, deasupra lor se notează masele molare înmulțite cu coeficienții respectivi din fața substanței.
Calculăm masa molară a H2O2 și a H2O :
μ H2O2 = 2 ∙ AH + 2 ∙ AO = 2 ∙ 1 + 2 ∙ 16 = 34 g/mol
μ H2O = 2 ∙ AH + 1 ∙ AO = 2∙ 1 + 1 ∙ 16 = 18 g/mol
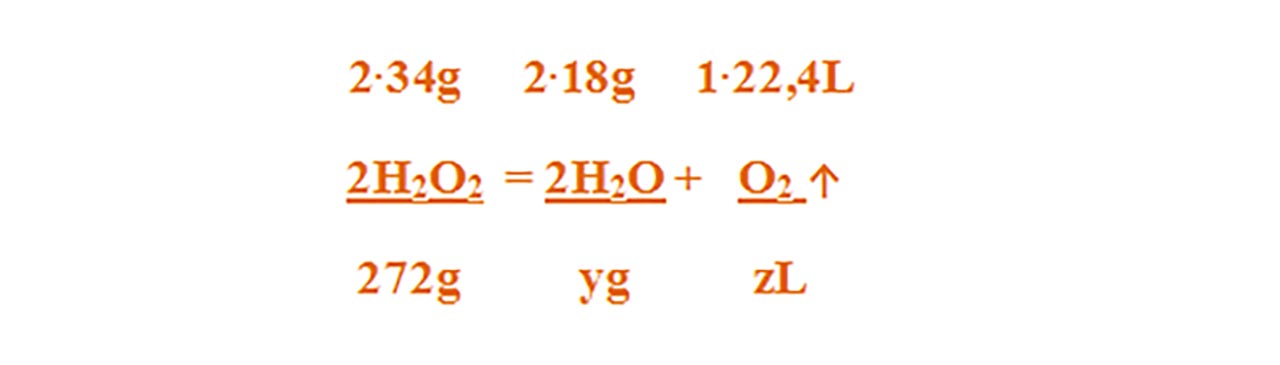
- Din proporțiile astfel obținute se calculează necunoscutele :

9066,67 g soluție H2O2 – 272 g H2O2 = 8794,67 g H2O din soluția inițială
z' = 8794,67 g H2O din soluția inițială + 144 g H2O rezultată în urma reacției de descompunere = 8.938,67 g H2O

III.7.3. Calcule stoechiometrice cu exces de substanță.
Problemă model
1) 20 L clor reacționează cu 11,2 L hidrogen.
Se cere:
a) Ce reactant este în exces și care este excesul de volum al acestuia ?
b) Masa acidului clorhidric obținut.
Rezolvare:
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
Cl2 + H2 = 2HCl ↑
Aceasta se citește astfel: 1 mol de clor reacționează cu 1 mol de hidrogen și rezultă 2 moli de acid clorhidric .
- Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe :
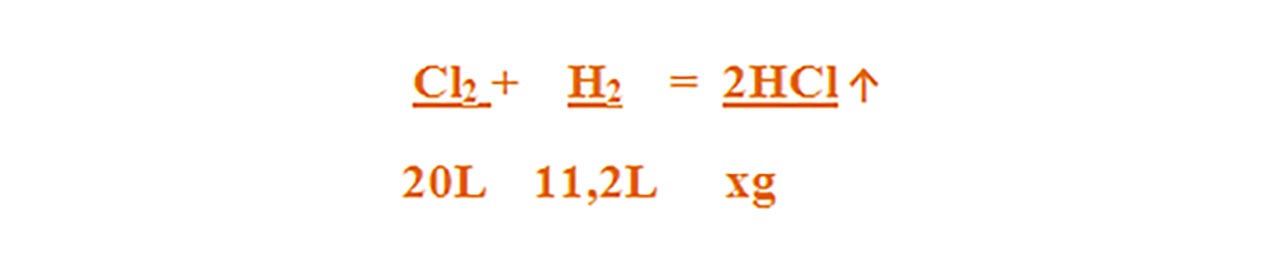
Calculăm masa molară a HCl :
- μ HCl = 1 ∙ AH + 1 ∙ ACl = 1 ∙ 1 + 1 ∙ 35,5 = 36,5 g/mol
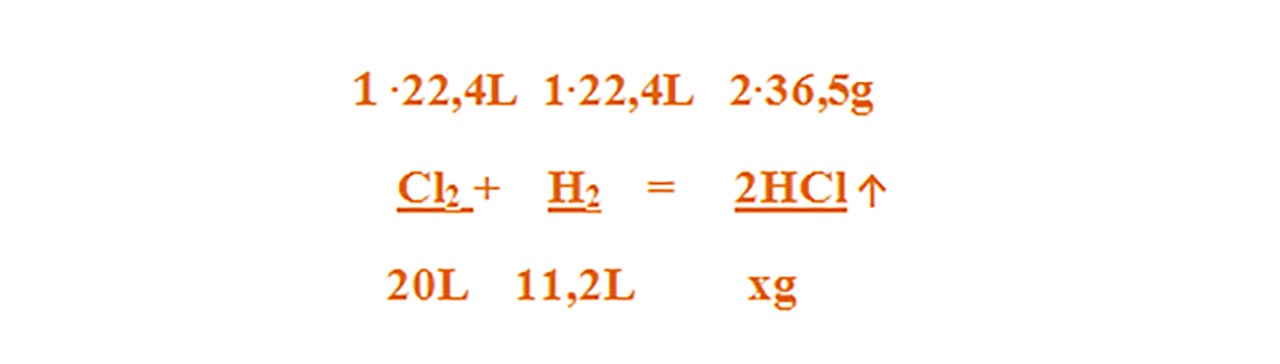
Deoarece 1 mol de clor reacționează cu 1 mol de hidrogen, înseamnă că clorul este în exces. Clorul trebuie să aibă același volum cu cel al hidrogenului.
- Vexces = 20 L – 11,2 L = 8,8 L exces Cl2
Din proporțiile astfel obținute se calculează necunoscutele:
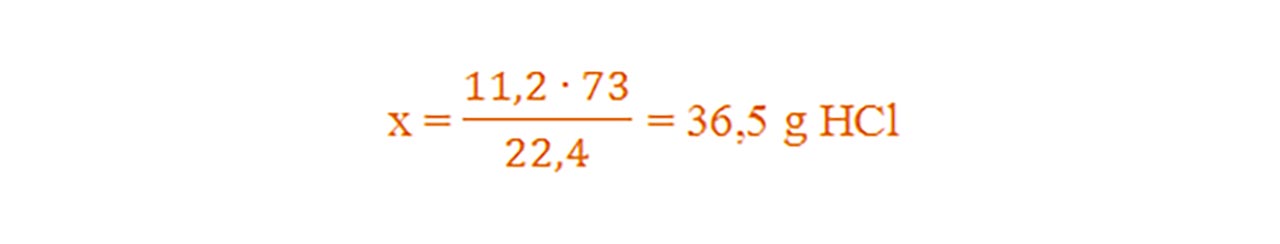
Problemă model
2) 168 g fier reacționează cu 112 L clor.
Se cere:
a) Ce reactant este în exces și care este excesul de volum al acestuia ?
b) Excesul de masă al reactantului.
Rezolvare:
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
- 2Fe + 3Cl2 = 2FeCl3
- Aceasta se citește astfel: 2 moli de fier reacționează cu 3 moli de clor și rezultă 2 moli de clorură de fier III .
Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe:
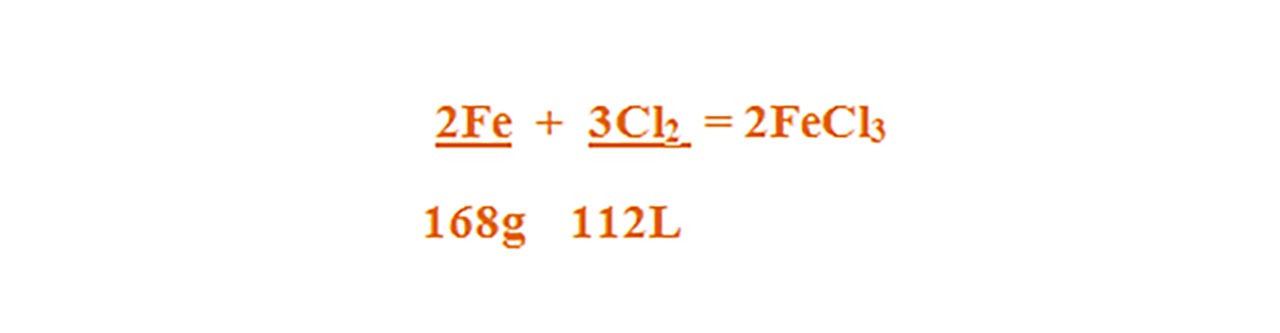
Calculăm masa molară a Cl2 :
- μ Cl2 = 2 ∙ ACl = 2 ∙ 35,5= 71 g/mol
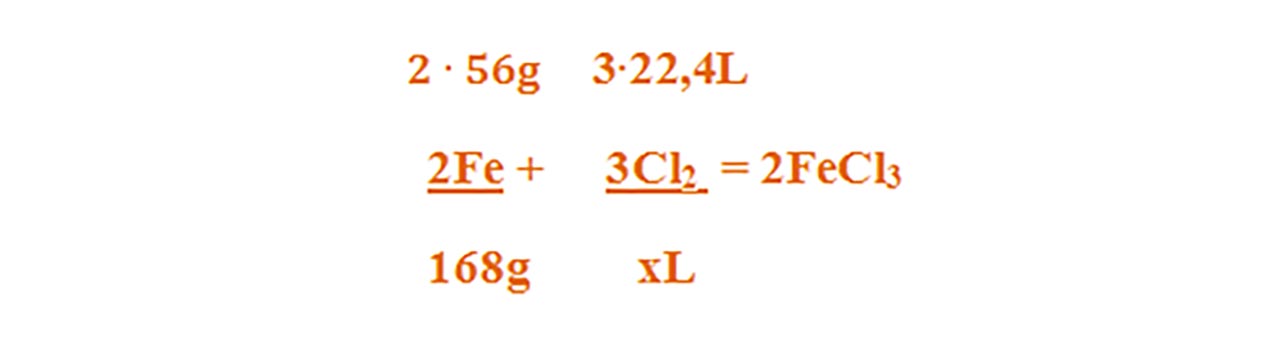
Calculăm raportul molar al reactanților conform ecuației chimice :
- nFe : nCl2 = 2 : 3
Calculăm numărul de moli al fiecărui reactant din datele problemei:
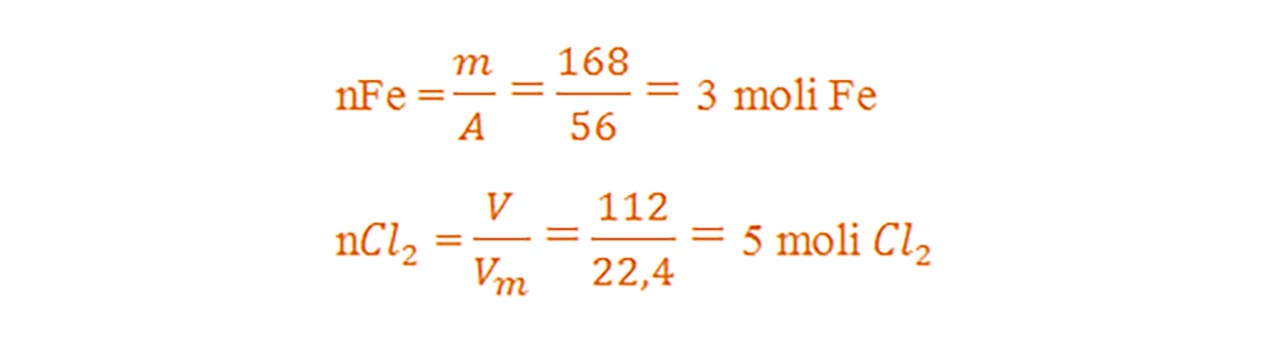
- Calculăm volumul de clor din ecuația chimică care trebuie să reacționeze cu 168 g Fe:

Calculăm volumul de clor în exces:
- Vexces = 112 L – 100,8 L = 11,2 L exces Cl2
Calculăm excesul de moli de clor:
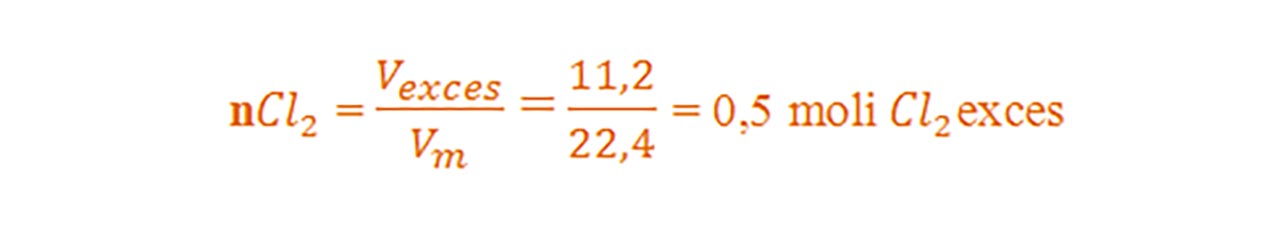
- Calculăm masa de clor în exces din formula nr. de moli :
